题目内容
3.已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用图中的装置进行实验.(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)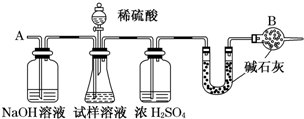
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到20.0g
④从分液漏斗滴入6mol•L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓通入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到22.0g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2g
请填空和回答问题:
(1)装置中干燥管B的作用防止空气中的CO2和水气进入U型管中.如果没有连接该干燥管,测试的结果偏高(填偏高、偏低或不变).
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果偏高(填偏高、偏低或不变).
(3)步骤⑤的目的是把反应产生的CO2全部导入U型管中,如果没有进行步骤⑤的操作,测试的结果偏低(填偏高、偏低或不变).
(4)试样中纯碱的质量分数为53%.
分析 (1)由于空气中也有二氧化碳和水分,干燥管B的作用就是不让它们进入的,如果没有连接该干燥管,则测量出的二氧化碳的质量偏大,据此分析;
(2)根据盐酸的挥发性考虑;
(3)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是为了驱赶它们的,如果没有进行步骤⑤的操作,则测量出的二氧化碳的质量偏小,据此分析;
(4)根据U型管的质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品质量即可.
解答 解:(1)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差,如果没有连接该干燥管,则测量出的二氧化碳的质量偏大,根据二氧化碳计算出的碳酸钠的质量分数也就偏高,
故答案为:防止空气中的CO2和水气进入U型管中;偏高;
(2)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大;
故答案为:偏高;
(3)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管,如果没有进行步骤⑤的操作,则测量出的二氧化碳的质量偏小,根据二氧化碳计算出的碳酸钠的质量分数也就偏低,
故答案为:把反应产生的CO2全部导入U型管中;偏低;
(4)根据实验步骤中的数据,生成二氧化碳的质量为22.2g-20g=2.2g,设需要碳酸钠的质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 2.2g
列比例式$\frac{106}{X}$=$\frac{44}{2.2g}$;
解得X=5.3g;
所以试样中纯碱的质量分数为$\frac{5.3}{10}$×100%=53%,
故答案为:53%.
点评 本题考查了物质组成定量测定的实验方案设计和分析判断,主要考查钠及其化合物的性质应用,容易出错的地方是不设计干燥管B,忘记空气中的二氧化碳和水分也能够进入U型管中,会使结果偏大,题目难度中等.

 习题精选系列答案
习题精选系列答案| A. | 小苏打-Na2CO3 | B. | 明矾-KAl(SO4)2 | ||
| C. | 漂白粉的有效成分-Ca(ClO)2 | D. | 水玻璃-H2SiO3 |
I.维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物,我们所熟悉的维生素有A、B、C、D、E等.其中
(1)维生素C又称抗坏血酸,人体自身不能合成维生素C;
(2)上述五种维生素中,属于水溶性维生素的是维生素B、维生素C.
Ⅱ.下表是某品牌火腿肠包装上的部分说明.
| 品 名 | ××火腿肠 |
| 部分配料 | ①淀粉 ②味精 ③亚硝酸钠 ④精选瘦肉 |
| 保质期 | 0℃~4℃30天 |
| 生产日期 | 见封口 |
Ⅲ.请将下列食品或药品对应的序号填入相应空格处:
①胃舒平 ②阿司匹林 ③铁强化酱油 ④食用碘盐
(1)预防甲状腺肿大应补充④,
(2)预防贫血应补充③,
(3)感冒患者可服用②,
(4)胃酸过多患者可服用①.
| A. | 5g H2和5g N2 | B. | 224mlN2(标准状况)和0.1molCO | ||
| C. | 16gO2和0.5molSO2 | D. | 22.4LH2O(标准状况)和1molO2 |
| A. | 人类需要的蛋白质可由鸡蛋提供,多吃有益 | |
| B. | 为防止变胖,炒菜时不放油 | |
| C. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| D. | 淀粉、油脂、蛋白质为人体提供热能,只要这三种摄入量足够就可以 |
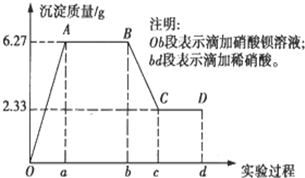 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示: 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出) .
.