题目内容
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
D
解析

练习册系列答案
相关题目
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀释相同倍数,BX溶液的pH变化小于BY溶液 |
| D.电离平衡常数K(BOH)小于K(HY) |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )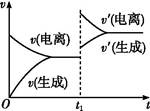
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
| A.若混合溶液的pH=7,则c1V1>c2V2 |
B.若V1=V2,c1=c2,则混合液中c(N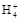 )=c(Cl-) )=c(Cl-) |
C.若混合液的pH=7,则混合液中c(N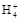 )>c(Cl-) )>c(Cl-) |
| D.若V1=V2,且混合液的pH<7,则一定有c1<c2 |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡下列叙述正确的是( )
CH3COO-+H+,对于该平衡下列叙述正确的是( )
| A.加入水时,平衡逆向移动 |
| B.加入少量NaOH固体,平衡正向移动 |
| C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡正向移动 |
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
| A.该溶液的pH<7 |
| B.CN-的水解程度大于HCN的电离程度 |
| C.c(CN-)+c(HCN)=0.02 mol·L-1 |
| D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+) |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于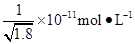 |
下列叙述不正确的是 ( )。
| A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像 |
| B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g |
| C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同 |
| D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液 |