题目内容
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
| A.若混合溶液的pH=7,则c1V1>c2V2 |
B.若V1=V2,c1=c2,则混合液中c(N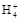 )=c(Cl-) )=c(Cl-) |
C.若混合液的pH=7,则混合液中c(N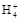 )>c(Cl-) )>c(Cl-) |
| D.若V1=V2,且混合液的pH<7,则一定有c1<c2 |
A
解析

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
| A.溶液的pH相同 |
| B.分别加入足量锌片,盐酸生成的H2体积大 |
| C.分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D.由水电离出的氢离子浓度均为1×10-12 mol·L-1 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )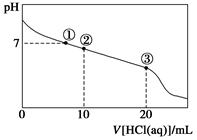
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是( )
| A.两溶液稀释前的浓度相同 |
| B.a、b、c三点溶液的pH由大到小顺序为a>b>c |
| C.a点的KW值比b点的KW值大 |
| D.a点水电离的c(H+)大于c点水电离的c(H+) |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是( )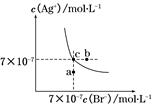
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
向50 mL 0.018 mol·L-1 AgNO3溶液中加入50 mL 0.02 mol·L-1盐酸。已知AgCl(s)的溶度积常数Ksp= 1×10-10,混合后溶液的体积变化忽略不计。下列说法不正确的是( )
| A.混合后,溶液中肯定有沉淀生成 |
| B.沉淀生成后溶液中Ag+的浓度为10-5 mol·L-1 |
| C.沉淀生成后溶液的pH=2 |
| D.混合后,升高温度,溶液中Ag+的浓度增大 |