题目内容
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
Hg(l)+ O2(g)=HgO(s) △H=-90.8kJ·mol-1
O2(g)=HgO(s) △H=-90.8kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
Hg(l)+
 O2(g)=HgO(s) △H=-90.8kJ·mol-1
O2(g)=HgO(s) △H=-90.8kJ·mol-1则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.-259.7 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.+519.4kJ·mol-1 | D.-519.4kJ·mol-1 |
A
试题分析:根据盖斯定律可知,反应①÷2-②即得到Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),所以该反应的反应热△H=-701.0kJ/mol÷2+90.8kJ/mol=-259.7kJ/mol,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是熟练掌握丙灵活运用盖斯定律即可。本题有利于培养学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目

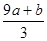 mol
mol 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量