题目内容
18.下列实验操作正确的是( )| A. | 中和热测定时,用浓硫酸代替盐酸与NaOH溶液反应 | |
| B. | 用25mL碱式滴定管准确量取25.00mLKMnO4 标准溶液 | |
| C. | 用玻璃棒蘸取0.10 mol•L-1CH3COOH溶液点在用水湿润的广泛pH试纸上,测定该溶液的pH=3.2 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
分析 A.浓硫酸溶于水放出热量,影响测定结果;
B.高锰酸钾具有氧化性,腐蚀橡皮管;
C.使用pH试纸时,试纸不能湿润,否则可能会影响测定结果;
D.相同条件下,只有催化剂不同.
解答 解:A.浓硫酸溶于水能够放出大量的热,影响测定结果,不能使用浓硫酸,应该使用稀硫酸与NaOH溶液反应测定中和反应的反应热,故A错误;
B.高锰酸钾具有氧化性,腐蚀橡皮管,应用酸式滴定管,故B错误;
C.使用pH试纸时,试纸不能湿润,否则会将待测液稀释,影响测定结果,故C错误;
D.相同条件下,只有催化剂不同,试管中加入2mL5%H2O2和1mLFeCl3溶液反应速率快,则可探究催化剂对H2O2分解速率的影响,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及中和滴定、pH测定及影响反应速率的因素等,把握物质的性质及反应原理为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
8.下列物质混合时,既能生成沉淀,又能产生气体的一组是( )
| A. | 碳酸钠和稀盐酸 | B. | 金属钠和硫酸铜溶液 | ||
| C. | 金属镁和硫酸铜溶液 | D. | 铝粉和氢氧化钠溶液 |
6.按下列分类,填写相应的名称或化学式
| 硫酸盐 | 硝酸盐 | ||
| Na2SO4 | NaNO3 | ||
| 钙盐 | CaSO4 | Ca(NO3)2 | CaCO3 |
13.下列反应中,H2O只作氧化剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
3.100mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示.则下列有关叙述正确的是( )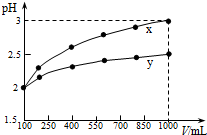

| A. | x为强酸,y为弱酸 | |
| B. | 稀释前x、y的物质的量浓度相等 | |
| C. | 随着稀释的进行,y的电离程度减小 | |
| D. | 等体积的x、y分别与足量的锌反应,y放出的氢气多 |
10.下列有关说法正确的是( )
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | SO2的催化氧化反应是一个放热反应,所以升高温度时,正反应速率减慢 | |
| C. | 反应CaCO3(s)=CaO(s)+CO2(g)的△S<0 | |
| D. | FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 |
8.用括号内的试剂除去下列各物质中少量的杂质,正确的是( )
| A. | 溴苯中的溴(碘化钾溶液) | B. | 硝基苯中的硝酸(氢氧化钠溶液) | ||
| C. | 乙烷中的乙烯(氢气) | D. | 苯中的甲苯(水) |
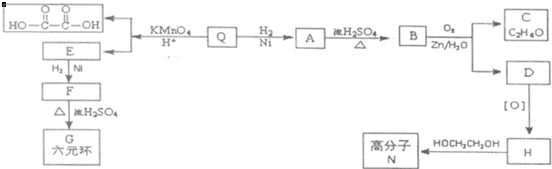
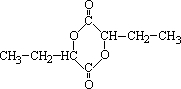 ;Q的反式结构简式是
;Q的反式结构简式是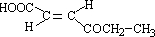 .
.
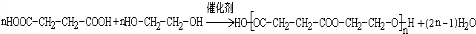 .
.