题目内容
13.下列反应中,H2O只作氧化剂的是( )| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
分析 反应中水只作氧化剂,说明该反应中有电子转移为氧化还原反应,且水中H元素得电子化合价降低,据此分析解答.
解答 解:A.该反应中,F元素化合价由0价变为-1价,水中O元素化合价由-2价变为0价,所以氟气是氧化剂、水是还原剂,故A错误;
B.该反应中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水作氧化剂、钠作还原剂,故B正确;
C.该反应中水中没有元素化合价变化,所以水既不是氧化剂又不是还原剂,故C错误;
D.该反应中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂,故D错误;
故选B.
点评 本题考查了氧化还原反应中还原剂、氧化剂的判断,明确基本概念的内涵是解本题关键,根据元素化合价变化结合概念来分析解答,难度不大.

练习册系列答案
相关题目
3.下列溶液肯定显酸性的是( )
| A. | 含H+的溶液 | B. | c(H+)=1×10-7mol•L-1 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
4.已知热化学方程式:2H2(g)+O2(g)═2H20(g)△H1=-△483.6kJ/mol,则对于热化学方程式:2H20(1)=2H2(g)+02(g)△H2=b,下列说法正确的是( )
| A. | 热化学方程式中化学计量数表示分子个数 | |
| B. | 该反应的△H2=+483.6kJ/mol | |
| C. | △H2<△H1 | |
| D. | △H1<△H2 |
1.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇:
CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是反应在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
18.下列实验操作正确的是( )
| A. | 中和热测定时,用浓硫酸代替盐酸与NaOH溶液反应 | |
| B. | 用25mL碱式滴定管准确量取25.00mLKMnO4 标准溶液 | |
| C. | 用玻璃棒蘸取0.10 mol•L-1CH3COOH溶液点在用水湿润的广泛pH试纸上,测定该溶液的pH=3.2 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
5.一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1,.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)<v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
3.海水中蕴藏着丰富的资源.海水综合利用的示意图如图:下列说法正确的是( )
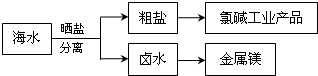

| A. | 通过氯碱工业可生产的产品仅仅为NaOH、Cl2 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→适量盐酸 | |
| C. | 可将MgCl2•6H2O晶体在空气中直接加热脱水得到较纯净的无水MgCl2 | |
| D. | 电解MgCl2溶液可制取金属镁 |