题目内容
18.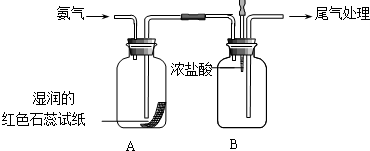 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质.①实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
②A中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显a(填字母);
a.碱性 b.还原性
③向B中滴入浓盐酸,现象是有白烟产生;
④A、B中的现象说明氨气能与H2O、HCl(填化学式)发生化学反应.
分析 ①氯化铵与氢氧化钙在加热条件下生成氨气、氯化钙、水;
②氨气与水反应生成一水合氨,一水合氨为弱碱,部分电离出氢氧根离子,溶液显碱性;
③氨气与氯化氢反应生成白色固体氯化铵;
④依据氨气的性质分析.
解答 解:①氯化铵与氢氧化钙在加热条件下生成氨气、氯化钙、水,离子方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O;
②氨气与水反应生成一水合氨,一水合氨为弱碱,部分电离出氢氧根离子,溶液显碱性,能够湿润的红色石蕊试纸变蓝;
故答案为:a;
③氨气与氯化氢反应生成白色固体氯化铵,看到现象为产生大量白烟;
故答案为:有白烟产生;
④A、B中的现象说明氨气能与H2O、HCl反应,分别生成一水合氨、氯化铵;
故答案为:H2O、HCl.
点评 本题考查了实验室制取氨气、氨气的性质等知识点,明确实验原理是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见表:
下列说法正确的是( )
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol |
9.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用烧碱溶液吸收尾气中少量二氧化碳:OH-+CO2═HCO3- | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 小苏打溶液中加入过量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
6.下列说法正确的是( )
| A. | 胆矾是纯净物,属于强电解质 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 含金属元素的离子一定都是阳离子 | D. | 阳离子只有氧化性 |
13.下列说法错误的是( )
| A. | 使用可降解塑料聚二氧化碳,能减少白色污染 | |
| B. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
7.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO${\;}_{4}^{2-}$的数目相同,则所取两溶液的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
 .
. 、
、 、
、 .
.