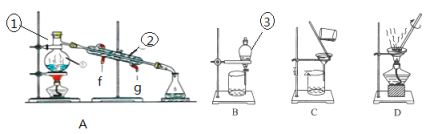
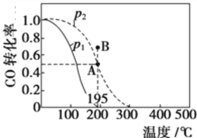
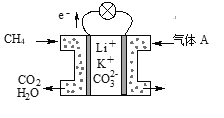
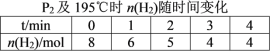题目内容
【题目】在湿法炼锌的电解循环溶液中,含较高浓度的![]() ,可向溶液中同时加入Cu和
,可向溶液中同时加入Cu和 ![]() ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去![]() ,反应原理如下:
,反应原理如下:![]() ;
;![]() ;室温时,实验测得电解液pH对溶液中残留
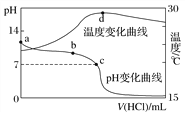
;室温时,实验测得电解液pH对溶液中残留![]() 的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
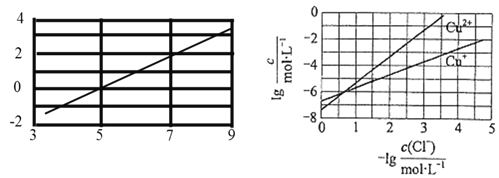
A.已知室温时AgCl的溶度积常数约为![]() ,则:
,则:![]()
B.向电解液中加入稀硫酸,有利于![]() 的除去
的除去
C.![]() 的平衡常数的数量级是
的平衡常数的数量级是![]()
D.除去上述电解循环溶液的产生![]() 的
的![]()
![]()
【答案】A
【解析】
A. 根据图示,当氯离子浓度的负对数为3.5时,即c(Cl-)=10-3.5mol/L,则c(Cu+)=10-3mol/L,![]() =c(Cl-) c(Cu+)=10-3.5mol/L×10-3mol/L=10-6.5,则
=c(Cl-) c(Cu+)=10-3.5mol/L×10-3mol/L=10-6.5,则![]() ,故A正确;
,故A正确;
B. 根据图中信息:溶液的pH越大,氯离子的浓度越小,电解液中加入稀硫酸,不利于![]() 的去除,故B错误;
的去除,故B错误;
C. 反应![]() ,其平衡常数为
,其平衡常数为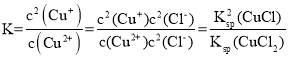 ,根据图二,当氯离子浓度负对数为0.5时,
,根据图二,当氯离子浓度负对数为0.5时,![]() =
=![]() =10-6mol/L,Ksp(CuCl2)=c(Cu2+)c2(Cl-)=10-7,代入数据得K=
=10-6mol/L,Ksp(CuCl2)=c(Cu2+)c2(Cl-)=10-7,代入数据得K=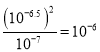 ,平衡常数的数量级是
,平衡常数的数量级是![]() ,故C错误;
,故C错误;
D. ![]() ,
,![]() ;
;
![]()
![]() ,
,![]() 可得到:
可得到:![]() ,根据盖斯定律反应的
,根据盖斯定律反应的![]()
![]() ,故D错误;
,故D错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,根据表中提供的有关信息,回答问题:
元素 | 相关信息 |
A | 所有单质中密度最小 |
B | 形成化合物种类最多的元素 |
D | 基态原子中只有3个能级,有2个未成对电子 |
E | 短周期中原子半径最大 |
F | 第三周期中电负性最大的元素 |
G | 最外层只有一个电子,内层填满电子 |
(1)E元素在周期表中的位置是______,F元素原子最外层电子排布式为______,BD2的立体构型为______。
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性,用离子方程式表示其显碱性的原因:______。
(3)氢化物稳定性:B______D;最高价氧化物对应的水化物酸性:C______F。(填“<”或“>”)
(4)每个B2A4分子中含有______个σ键,______个π键。