题目内容
A、B、C、D是元素周期表中前三周期里的四种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30,离子D—的核外电子排布与Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1)写出上述四种元素的名称:A______,B______,C______,D______。
(2)写出AD2的电子式 :__________,属于。
(3)D单质与水反应的化学方程式为_________________________________________。
【答案】
(1)镁;氢;氯;氟。
(2)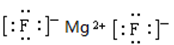 离子 (3)2F2+2H2O=4HF+O2↑
离子 (3)2F2+2H2O=4HF+O2↑
【解析】
试题分析:根据组成AD2可判断A、D所在族为ⅡA族、ⅦA族或ⅣA族、ⅥA族。由于D—结构与Al3+相同,故D元素为F。由AD2中核外电子数为30,推知A为Mg。BC水溶液为强酸且质子数之和为18,知B为H,C为Cl。
考点:考查元素周期表的结构以及元素周期律的应用
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
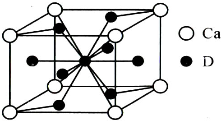 (5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
