题目内容
15.利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁.其工艺流程如下: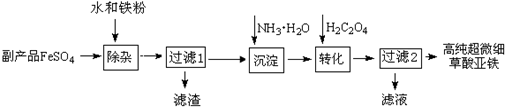
(1)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3,请写出TiOSO4 水解成 H2TiO3沉淀的化学方程式TiOSO4+2H2O=H2TiO3↓+H2SO4;铁粉的作用有:①除去溶液中的Fe3+,②与溶液中的H+反应,调节pH值,使Al3+水解完全生成Al(OH)3沉淀.
(2)沉淀反应的离子方程式是2NH3•H2O+Fe2+=Fe(OH)2↓+2NH4+.
(3)沉淀过程的反应温度为40℃,温度不宜过高的原因除控制沉淀的粒径之外,还有NH3•H2O和Fe(OH)2受热都易分解
(4)FeC2O4生成后,为提高产品纯度还需调节溶液pH=2,若pH过低,则导致FeC2O4产率偏低(填“偏高”、“偏低”或“无影响”).
(5)过滤2得到的滤液经蒸发浓缩冷却结晶、过滤,可得到副产品,该物质可用作化肥(写出一种用途).
分析 副产品FeSO4(含TiO2+、Al3+)中加入水和铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀,
(1)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性,Fe可以与氢离子反应调节pH;
(2)一水合氨水是弱碱不能拆,与亚铁离子生成氢氧化亚铁沉淀,据此书写离子反应方程式即可;
(3)氨水受热易分解,难溶性碱也具有热不稳定性,据此解答即可;
(4)氢氧化亚铁能与氢离子发生反应据此解答即可;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥.
解答 解:(1)反应物为TiOSO4和H2O,已知产物为H2TiO3,根据原子守恒可知另一产物为硫酸,因此化学方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,调节pH值,使Al3+水解完全生成Al(OH)3 沉淀,
故答案为:TiOSO4+2H2O=H2TiO3↓+H2SO4;与溶液中的H+反应,调节pH值,使Al3+水解完全生成Al(OH)3 沉淀;
(2)一水合氨是弱碱,与亚铁离子生成氢氧化亚铁沉淀,氨水不能拆,沉淀不能拆,故离子反应方程式为:2NH3•H2O+Fe2+=Fe(OH)2↓+2NH4+,
故答案为:2NH3•H2O+Fe2+=Fe(OH)2↓+2NH4+;
(3)氨水受热易分解生成氨气和水,氢氧化亚铁也具有热不稳定性,容易分解生成氧化物和水,故答案为:NH3•H2O和Fe(OH)2受热都易分解;
(4)由于中间产物Fe(OH)2能与H+反应,如果溶液酸性过强,则会使FeC2O4的产率下降,故答案为:偏低;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥,故答案为:冷却结晶、过滤;化肥.
点评 本题考查氧化还原反应、离子除杂等相关知识,突出检验学生信息收集、整合、分析问题解决问题的能力,试题开放性强,有些答案不唯一,整体难度中等.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
| A. | 从柑桔中可提炼出苧烯( ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 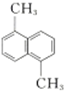 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
| 序号 | 溶液 | 是否产生沉淀 | 沉淀成分 |
| ① | Ca(OH)2 | ||
| ② | BaCl2 | ||
| ③ | BaCl2和氨水 | ||
| ④ | BaCl2和氯水 | ||
| ⑤ | H2S | ||
| ⑥ | Ba(NO3) |
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
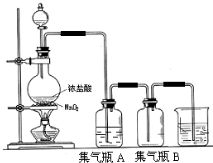 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O