题目内容
4.用CaSO4代替O2与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图1所示.燃烧器中反应①$\frac{1}{4}$CaSO4(s)+H2(g)=$\frac{1}{4}$CaS(s)+H2O(g)△H1(主反应)
反应②CaSO4(s)+H2(g)=CaO(s)+SO2(g)+H2O(g)△H2(副反应)
再生器中反应:$\frac{1}{2}$CaS(s)+O2(g)=$\frac{1}{2}$CaSO4(s)△H3

(1)气化反应器中发生反应的化学方程式是C+H2O$\stackrel{高温}{?}$CO+H2.
(2)燃烧器中SO2物质的量分数随温度T、压强p (MPa)的变化曲线见图2,从图2中可以得出三条主要规律:
①其他条件不变,温度越高,SO2含量越高;
②在温度一定时,压强越高,SO2含量越低;
③其它条件不变时,压强越小,温度对SO2含量的影响越明显;
由图2,为减少SO2的排放量,可采取的措施是降低温度,增加压强.
(3)该燃烧技术中可循环的物质除CaSO4、CaS外,还有水蒸气(写名称).
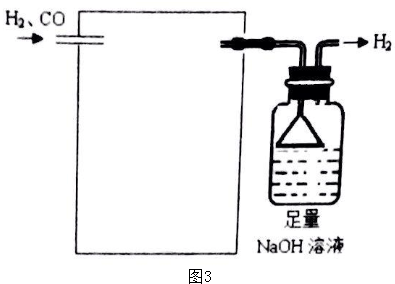
(4)欲采用氯化钯(PdCl2)溶液除去H2中的CO,完成以下实验装置图3:(注:CO+PdCl2+H2O=CO2+Pd+2HCl)
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将2.0×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为5.6×10-5mol•L-1.(保留二位有效数字)
分析 (1)根据图1的流程图可知,气化反应器中反应物为碳和水,生成物为氢气和一氧化碳;
(2)根据图2可知,在温度一定时可比较出SO2含量与压强的关系,以及在不同压强下,温度对SO2含量的影响不同;根据图2可知,温度越低,压强越大,SO2含量越小;
(3)根据图1的流程图可知,该燃烧技术中可循环的物质除CaSO4、CaS外,还有水;
(4)欲采用氯化钯(PdCl2)溶液除去H2中的CO,需要用一个洗气装置,装置中装足量的PdCl2溶液,据此画图;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)根据图1的流程图可知,气化反应器中反应物为碳和水,生成物为氢气和一氧化碳,反应方程式为C+H2O$\stackrel{高温}{?}$CO+H2,
故答案为:C+H2O$\stackrel{高温}{?}$CO+H2;
(2)根据图2可知,在温度一定时,压强越高,SO2含量越低;其它条件不变时,压强越小,温度对SO2含量的影响越明显;根据图2可知,温度越低,压强越大,SO2含量越小,所以要减少SO2的排放量,可以降低温度,增加压强,
故答案为:在温度一定时,压强越高,SO2含量越低;其它条件不变时,压强越小,温度对SO2含量的影响越明显;降低温度,增加压强;
(3)根据图1的流程图可知,该燃烧技术中可循环的物质除CaSO4、CaS外,还有水蒸气,
故答案为:水蒸气;
(4)欲采用氯化钯(PdCl2)溶液除去H2中的CO,需要用一个洗气装置,装置中装足量的PdCl2溶液,装置图为 ,
,
故答案为: ;
;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mol•L-1.
点评 本题考查了工业流程图、化学平衡的图象、有机物结构、除杂实验等,题目难度中等,试题涉及内容较多,注意基础知识的灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | CH4与C2H4 | |
| B. | CH3-CH=CH-CH3 与 CH3-CH2-CH2-CH3 | |
| C. | O2与O3 | |
| D. | C2H6与C3H8 |
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HCl) | c(MOH) | ||
| ① | 0.1 | 0.1 | 5 |
| ② | 0.2 | x | 7 |
| ③ | 0.1 | 0.2 | 10 |
| ④ | 0.2 | 0.1 | y |
| A. | 实验①反应后的溶液中:c(MOH)约为1×10-5 mol•L-1 | |
| B. | 实验②反应后的溶液中:c(MOH)>c(M+)=c(Cl-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(M+)+c(H+)=c(OH-)+c(MOH) | |
| D. | 实验④反应后的溶液中:c(H+)-c(OH-)-c(MOH)=0.05mol•L-1 |
| A. | 在酸性重铬酸钾溶液中加入少量乙醇:3COH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O | |
| B. | AlCl3•6H2O与SOCl2混合并加热:AlCl3•6H2O+3SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3SO2↑+9HCl | |
| C. | SbCl3水解:SbCl3+H2O?SbOCl+2HCl | |
| D. | 在碘的四氯化碳溶液中加浓的KI溶液:I2+3I-?I3- |
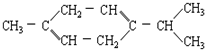 还可以简写为
还可以简写为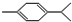 ,下列有机物中,与上述有机物互为同分异构体的是( )
,下列有机物中,与上述有机物互为同分异构体的是( )


 .
.