题目内容
【题目】下列框图中的物质均为中学化学常见物质。已知A、B、C均为有刺激性气味的气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体。反应①需要有水参加,反应②有大量白烟生成。
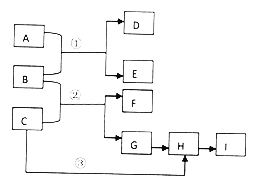
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①_____________________________________;
反应②_______________________________________;
反应③____________________________________________;
(2)用Na2CO3溶液吸收I生成CO2,若9.2gI和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为__________________________________。
【答案】 SO2+Cl2+H2O=H2SO4+2HCl 3Cl2+8NH3=N2+6NH4Cl 4NH3+5O2![]() 4NO+6H2O 2NO2+CO32-=NO2-+NO3-+CO2
4NO+6H2O 2NO2+CO32-=NO2-+NO3-+CO2
【解析】分析:已知A、B、C均为有刺激性气味的气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色,因此C是氨气,B是氯气,则A是SO2;反应①需要有水参加,因此D和E是盐酸、硫酸。反应②有大量白烟生成,H为无色气体,I为红棕色气体,I是NO2,所以H是NO,G是氮气,F是氯化铵,据此解答。
详解:根据以上分析可知A是SO2,B是Cl2,C是NH3,D和E是盐酸与硫酸中的一种,F是NH4Cl,G是N2,H是NO,I是NO2,则
(1)根据以上分析可知反应①的方程式为SO2+Cl2+H2O=H2SO4+2HCl,反应②的方程式为3Cl2+8NH3=N2+6NH4Cl,反应③的方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)用Na2CO3溶液吸收I生成CO2,若9.2g I和Na2CO3溶液完全反应时转移0.1mol电子,9.2g NO2的物质的量是9.2÷46g/mol=0.2mol,这说明2mol二氧化氮转移1mol电子,因此二氧化氮在反应中一半被氧化为硝酸根,一半被还原为亚硝酸根,则反应的离子方程式为2NO2+CO32-=NO2-+NO3-+CO2。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
