题目内容
【题目】I.铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题:
(1)放电时,负极材料是___;电解液中H2SO4的浓度将变___(选“变大”“变小”或“不变”);
(2)充电时,阳极的电极反应式是___。
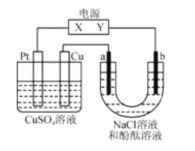
II.如图是一个化学过程的示意图。

(1)图中甲池是___装置(填“电解池”或“原电池”),其中K+移向___极(选“正”或“负”)
(2)乙池中石墨电极A上发生的电极反应式:___。
(3)若丙内为足量NaCl溶液,当甲池内通入11.2LO2(标准状况下),则丙池中产生的气体的体积为____L(标准状况下)。
【答案】Pb 变小 PbSO4 + 2H2O - 2e- = PbO2 + 4H+ + SO42- 原电池 正极 2H2O-4e-=O2↑4H+ 44.8 L
【解析】
I(1)Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,放电时,Pb作为负极,所以负极的电极反应式是Pb+SO42--2e-=PbSO4,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;
2PbSO4+2H2O,放电时,Pb作为负极,所以负极的电极反应式是Pb+SO42--2e-=PbSO4,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;
(2)充电时,阳极上硫酸铅失电子生成PbO2,电极反应式是:PbSO4 + 2H2O - 2e- = PbO2 + 4H+ + SO42-;
II. (1)燃料电池是化学能转变为电能的装置,甲池属于原电池,原电池工作时,电解质溶液中K+向正极移动;
(2)甲池中通入O2的为正极,通入CH3OH的为负极,乙池有外接电源属于电解池,连接原电池正极的A是阳极,A电极上水得电子生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑4H+;
(3)若丙内为足量NaCl溶液,当甲池内通入11.2LO2(标准状况下)即0.5molO2,转移电子的物质的量为4×0.5mol=2mol,根据丙中电极总反应2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,转移2mol电子生成2mol气体,则丙池中产生的气体体积(标准状况)为2mol×22.4L/mol=44.8 L。
2NaOH+H2↑+Cl2↑,转移2mol电子生成2mol气体,则丙池中产生的气体体积(标准状况)为2mol×22.4L/mol=44.8 L。