题目内容
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法不正确的是
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: |
D
解析试题分析:A、电解氯化钠溶液得到氢气、氢氧化钠和氯气,把电能转化为化学能,正确;B、镁离子水解生成氢氧化镁和氯化氢,加热促进水解,因此为了防止镁离子水解,则要在HCl氛围中加热脱水制得无水MgCl2,正确;C、在过程③⑤中溴元素的化合价升高,均被氧化,正确;D、Ca2+用碳酸钠除去,Mg2+、Fe3+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,错误。
考点:本题考查能量转化、水解原理的应用、氧化还原反应以及物质除杂的有关判断。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验操作中错误的是( )。
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.将蒸发皿放置在三脚架上直接用酒精灯火焰加热 |
| D.过滤后洗涤沉淀,是将水沿玻璃棒注入漏斗中,用玻璃棒搅拌后待水流下 |
对下列实验过程的评价,正确的是
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B.验证溶液中是否含有Cl-,加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl- |
| C.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D.某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
用现有三组溶液:①汽油和氯化钠溶液②汽油和柴油的混合物③从氯化钠和单质碘的水溶液中分离出碘,分离以上物质正确方法依次是( )
| A.分液、蒸馏、萃取 | B.萃取、蒸发、分液 |
| C.分液、萃取、蒸馏 | D.蒸馏、萃取、分液 |
下列有关实验的做法错误的是
| A.分液时,分液漏斗中的上层液体应由上口倒出 |
| B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体 |
| C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl- |
| D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3 |
下列仪器常用于物质分离的是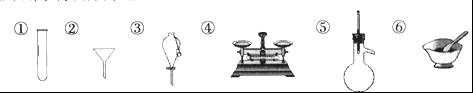
| A.①③⑤ | B.②③⑤ | C.②④⑤ | D.①④⑥ |
要将含有杂质的工业乙醇提纯,通常采用的方法是
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是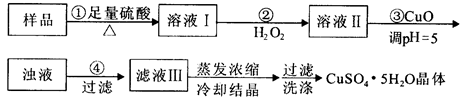
| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次 |
| D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g |
可用来鉴别乙烯、四氯化碳、苯的方法是
| A.磺化反应 | B.溴水 | C.液溴 | D.硝化反应 |