题目内容
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
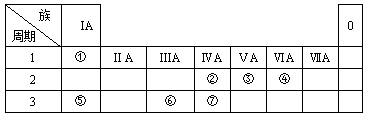
(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。

(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
(11分)(1)Na>Al>O HNO3>H2CO3>H2SiO3
(2)CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)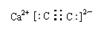 3CO+Fe2O3
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0 kJ·mol-1
(5)Al-3e-=Al3+ Al3++3HCO3-=Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
(2)CO32-+H2O
 HCO3-+OH-
HCO3-+OH-(3)
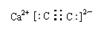 3CO+Fe2O3
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2 (4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0 kJ·mol-1
(5)Al-3e-=Al3+ Al3++3HCO3-=Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
(1)④、⑤、⑥分别是O、Na、Al,据它们在周期表中的位置可知,原子半径由大到小的顺序为Na>Al>O;②、③、⑦分别是C、N、Si,据它们在周期表中的位置可知,三种元素非金属性强弱顺序为N>C>Si,故它们的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3。
(2)由C、O、Na三种元素组成的常见物质是Na2CO3,Na2CO3是强碱弱酸盐,因CO32-的水解溶液呈碱性。
(3)C、N、O三种元素中一种或两种元素形成的双原子分子或负二价阴离子有N2、O2、CO、NO、C22-和O22-,其中N2、CO和C22-的电子总数均为14,符合题设条件的甲、乙分别是C22-和CO。甲与钙元素组成的化合物是CaC2,其电子式为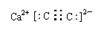 ;CO在工业上用于铁的冶炼。
;CO在工业上用于铁的冶炼。
(4)Si的氢化物的分子式为SiH4,SiH4完全燃烧的化学方程式为SiH4+2O2=SiO2+2H2O,1molSiH4完全燃烧转移8mol e-,同时放出热量:190.0kJ×8=1520.0 kJ,所以SiH4完全燃烧的热化学方程式是SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0 kJ·mol-1。
(5)用Al作阳极电解NaHCO3溶液时,Al失去电子生成Al3+,Al3+在阳极附近与溶液中的HCO3-发生双水解反应生成有吸附性的难溶物Al(OH)3,同时放出CO2气体。
(2)由C、O、Na三种元素组成的常见物质是Na2CO3,Na2CO3是强碱弱酸盐,因CO32-的水解溶液呈碱性。
(3)C、N、O三种元素中一种或两种元素形成的双原子分子或负二价阴离子有N2、O2、CO、NO、C22-和O22-,其中N2、CO和C22-的电子总数均为14,符合题设条件的甲、乙分别是C22-和CO。甲与钙元素组成的化合物是CaC2,其电子式为
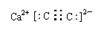 ;CO在工业上用于铁的冶炼。
;CO在工业上用于铁的冶炼。(4)Si的氢化物的分子式为SiH4,SiH4完全燃烧的化学方程式为SiH4+2O2=SiO2+2H2O,1molSiH4完全燃烧转移8mol e-,同时放出热量:190.0kJ×8=1520.0 kJ,所以SiH4完全燃烧的热化学方程式是SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0 kJ·mol-1。
(5)用Al作阳极电解NaHCO3溶液时,Al失去电子生成Al3+,Al3+在阳极附近与溶液中的HCO3-发生双水解反应生成有吸附性的难溶物Al(OH)3,同时放出CO2气体。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


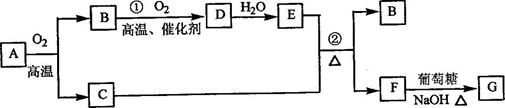
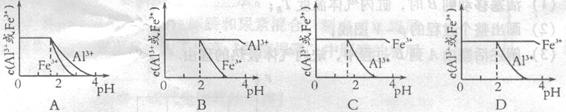
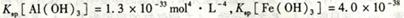 mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是