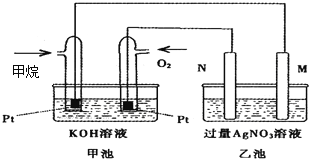
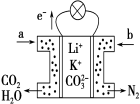
题目内容
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液(此时不考虑CO32-的水解),滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为w点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. 此温度下,Ksp(CaCO3)=1x10-8.6
【答案】D
【解析】A,z点在曲线下方,z点对应的分散系为悬浊液,悬浊液不稳定,A项错误;B,由图知w、x、y点c(Ca2+)依次减小,溶液中c(CO32-):w![]() x
x![]() y,CO32-水解促进水的电离,溶液中OH-全部来自水电离,CO32-浓度越大溶液碱性越强,水的电离程度最大的为y点,B项错误;C,CaSO4微溶于水,CaSO4的溶解度大于CaCO3,若用等浓度的Na2SO4溶液代替Na2CO3溶液,图像在x点后的变化应在实线下方,C项错误;D,当加入10mLNa2CO3溶液时,CaCl2与Na2CO3恰好完全反应,此时c(Ca2+)=c(CO32-)=10-4.3mol/L,Ksp(CaCO3)= c(Ca2+)·c(CO32-)=10-8.6(mol/L)2,D项正确;答案选D。
y,CO32-水解促进水的电离,溶液中OH-全部来自水电离,CO32-浓度越大溶液碱性越强,水的电离程度最大的为y点,B项错误;C,CaSO4微溶于水,CaSO4的溶解度大于CaCO3,若用等浓度的Na2SO4溶液代替Na2CO3溶液,图像在x点后的变化应在实线下方,C项错误;D,当加入10mLNa2CO3溶液时,CaCl2与Na2CO3恰好完全反应,此时c(Ca2+)=c(CO32-)=10-4.3mol/L,Ksp(CaCO3)= c(Ca2+)·c(CO32-)=10-8.6(mol/L)2,D项正确;答案选D。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
 △H<0
△H<0
相关物理常数:
名称 | 相对分子质量 | 密度(20℃) g/cm3 | 熔点(℃) | 沸点(℃) | 溶解度S(g100g溶剂) | ||
水 | 乙醇 | 乙醚 | |||||
环己醇 | 100 | 0.96 | 25.2 | 161 | 可溶 | 易溶 | |
己二酸 | 146 | 1.36 | 151 | 265 | 可溶(S随温度降低而减小) | 易溶 | 微溶 |
I.己二酸粗产品的制备
操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安 装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:

(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
(2) 装置右侧烧杯中的NaOH 溶液的作用是:_______________。
II.己二酸粗产品的提纯及应用
操作流程:趁热倒出装置C 中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,再分别用3mL 冰水和乙醚洗涤己二酸晶体,继续抽滤,晶体再用3mL冰水洗涤一次,再抽滤。取出产品,干燥后称重,得干燥的己二酸0.860g。
请回答下列问题:
(3) 相比于普通过滤,抽滤的优点在于:_________
(4)在抽滤过程中,用冰水洗涤析出的己二酸晶体的原因:___________。
(5)该实验的产率为: _______% (结果保留3 位有效数字)
(6)工业上用己二酸与乙二醇反应形成链状高分子化合物,写出化学方程式:________。
【题目】温度会影响微生物的生存和繁殖.下表为大肠杆菌在不同温度下繁殖l代所用的时间(min).根据表格可直接得出哪项结论( )
温度 | 10℃ | 15℃ | 20℃ | 25℃ | 30℃ | 35℃ | 40℃ | 45℃ | 50℃ | ||
时间 | 860 | 120 | 90 | 40 | 29 | 22 | 1 | 5 | 2 | 0 | 80 |
A.10℃时细菌繁殖最快 B.温度越高酶活性越强
C.低温可抑制细菌繁殖 D.酶的活性受时间控制