题目内容
【题目】己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
 △H<0
△H<0
相关物理常数:
名称 | 相对分子质量 | 密度(20℃) g/cm3 | 熔点(℃) | 沸点(℃) | 溶解度S(g100g溶剂) | ||
水 | 乙醇 | 乙醚 | |||||
环己醇 | 100 | 0.96 | 25.2 | 161 | 可溶 | 易溶 | |
己二酸 | 146 | 1.36 | 151 | 265 | 可溶(S随温度降低而减小) | 易溶 | 微溶 |
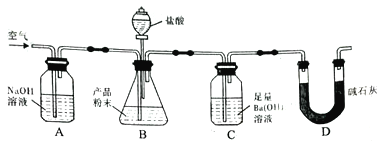
I.己二酸粗产品的制备
操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安 装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:

(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
(2) 装置右侧烧杯中的NaOH 溶液的作用是:_______________。
II.己二酸粗产品的提纯及应用
操作流程:趁热倒出装置C 中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,再分别用3mL 冰水和乙醚洗涤己二酸晶体,继续抽滤,晶体再用3mL冰水洗涤一次,再抽滤。取出产品,干燥后称重,得干燥的己二酸0.860g。
请回答下列问题:
(3) 相比于普通过滤,抽滤的优点在于:_________
(4)在抽滤过程中,用冰水洗涤析出的己二酸晶体的原因:___________。
(5)该实验的产率为: _______% (结果保留3 位有效数字)
(6)工业上用己二酸与乙二醇反应形成链状高分子化合物,写出化学方程式:________。
【答案】 水浴 维持反应速率,并减少HNO3的挥发及分解,减少副反应的发生 吸收HNO3被还原生成的氮氧化物,防止污染空气 加快过滤速度,减少过滤过程中产品的变质,得到较干燥的产品 除去残留的HNO3,减小己二酸的损失 58.9 
【解析】试题分析:本题考查己二酸的制备和提纯、产率的计算、有机方程式的书写。
(1)反应需维持温度在85~90℃,低于100℃,最好采取水浴控温。维持温度在85~90℃的原因:维持反应速率(或温度过低反应速率慢),减少HNO3的分解和挥发(或温度过高HNO3分解和挥发),减少副反应的发生。
(2)在反应中环己醇被氧化,HNO3被还原成氮氧化物,右侧烧杯中的NaOH溶液的作用是:吸收HNO3被还原生成的氮氧化物,防止污染大气。
(3)相比于普通过滤,抽滤的优点在于:减小压强加快过滤速率,减少过滤过程中产品的变质,得到较干燥的产品。
(4)己二酸中混有环己醇和HNO3,环己醇易溶于乙醚,己二酸微溶于乙醚,抽滤时用乙醚洗涤除去环己醇。HNO3易溶于水,己二酸在水中的溶解度随温度降低而减小,用冰水洗涤析出的己二酸晶体的原因:除去残留的HNO3,减少己二酸的损失。
(5)n(环己醇)=1.000g![]() 100g/mol=0.01mol,理论上生成己二酸物质的量为0.01mol,生成己二酸的质量为0.01mol
100g/mol=0.01mol,理论上生成己二酸物质的量为0.01mol,生成己二酸的质量为0.01mol![]() 146g/mol=1.46g,该实验的产率为
146g/mol=1.46g,该实验的产率为![]() 100%=58.9%。
100%=58.9%。
(6)己二酸属于二元酸,乙二醇属于二元醇,两者发生缩聚反应形成高分子化合物,反应的化学方程式为nHOOC(CH2)4COOH+nHOCH2CH2OH![]()
![]() +(2n-1)H2O。
+(2n-1)H2O。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案