题目内容
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10 nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
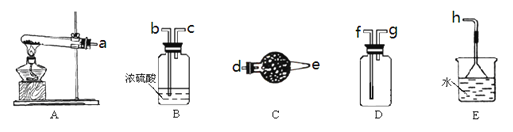
(1)实验室选用上图所示装置制取、收集干燥的NH3,接口的连接顺序是:a接_____(填小写字母代号,下同),_____接___,_____接h。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是____,试写出制纳米级碳酸钙的离子方程式:_____。
(3)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量,溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子):____。
(4)取反应后去除CaCO3的溶液分别做以下实验,下列实验判断合理的是_____(填字母代号)。
A.滴加少量Na2CO3溶液,若有沉淀生成,说明CO2一定不足
B.滴加少量盐酸,若有气泡产生,说明CO2一定过量
C.测量溶液pH,若pH小于7,说明CO2一定过量
D.滴加少量BaCl2溶液,若无沉淀生成,说明CO2一定没有过量
【答案】d e g f NH3 Ca2++2NH3+H2O+CO2===CaCO3+2NH4+ Ca2+、HCO3—、NH4+、Cl- B
【解析】
(1)实验式通常用氯化铵与氢氧化钙加热的条件下制取氨气,并收集干燥的氨气,则连接装碱石灰的装置;氨气的密度小于空气,则应g进f出;最后用E吸收过量的氨气;
(2)为了提高二氧化碳的吸收效果,先通氨气使溶液呈碱性,再通二氧化碳气体;
(3)二氧化碳能与碳酸钙、水反应生成碳酸氢钙;
(4) A.若二氧化碳过量时,溶液存在Ca2+,滴加少量Na2CO3溶液,有沉淀生成;
B.滴加少量盐酸,若有气泡产生,则溶液中存在HCO3-;
C.无论二氧化碳过量与否,溶液主要为氯化铵,溶液显酸性;
D.无论二氧化碳过量与否,滴加少量BaCl2溶液,均无沉淀生成。
(1)实验式通常用氯化铵与氢氧化钙加热的条件下制取氨气,题目要求收集干燥的氨气,则连接装置C,其为碱石灰,起干燥作用应d进e出;氨气的密度小于空气,则应g进f出;最后用E吸收过量的氨气,其易溶于水,则用防倒吸装置;
(2)为了提高二氧化碳的吸收效果,应先通氨气,使溶液呈碱性,再通二氧化碳气体,制取纳米级碳酸钙的离子方程式为Ca2++2NH3+H2O+CO2===CaCO3+2NH4+;
(3)二氧化碳能与碳酸钙、水反应生成碳酸氢钙,CO2过量时,导致碳酸钙变为碳酸氢钙,则溶液中存在大量的钙离子、碳酸氢根离子,和未参与反应的铵根离子、氯离子;
(4) A.若二氧化碳过量时,溶液存在Ca2+,滴加少量Na2CO3溶液,有沉淀生成,不能判断CO2是否足量,A错误;
B.滴加少量盐酸,若有气泡产生,则溶液中存在HCO3-,说明CO2一定过量,B正确;
C.无论二氧化碳过量与否,溶液主要为氯化铵,溶液显酸性,测量溶液pH小于7,不能说明CO2一定过量,C错误;
D.无论二氧化碳过量与否,滴加少量BaCl2溶液,均无沉淀生成,不能说明CO2一定没有过量,D错误;
答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
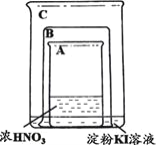
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝