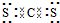题目内容
Q、R、X、Y、Z为短周期元素,它们的原子序数依次增大.Q的低价氧化物与R单质分子中的电子总数相等,Q与X同族,X在地壳中含量居第二位.Y、Z分别与Q形成的共价化合物化学式为QY2、QZ4.
(1)X、Y、Z气态氢化物的稳定性由强到弱的顺序是(用分子式表示)
(2)X在周期表中的位置是
(3)R单质的电子式为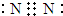
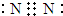 ,其氢化物的分子构型为
,其氢化物的分子构型为
(4)Q与Y形成的直线型分子QY2属于
(1)X、Y、Z气态氢化物的稳定性由强到弱的顺序是(用分子式表示)
HCl>H2S>SiH4
HCl>H2S>SiH4
.(2)X在周期表中的位置是
第三周期ⅣA族
第三周期ⅣA族
,若将其单质投入到氢氧化钠溶液中,发生反应的离子方程式为Si+2OH-+H2O═SiO32-+2H2↑
Si+2OH-+H2O═SiO32-+2H2↑
(3)R单质的电子式为
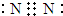
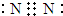
三角锥型
三角锥型
,该氢化物发生催化氧化反应的化学方程式为4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(4)Q与Y形成的直线型分子QY2属于
非极性
非极性
分子(填“极性”或“非极性”).分析:Q、R、X、Y、Z为短周期元素,它们的原子序数依次增大.X在地壳中含量居第二位,则X为Si;Q与X同族,则Q为C;Q的低价氧化物为CO,与R单质分子中的电子总数相等,则R单质分子含有电子总数为14,结合原子序数可知R为N;Y、Z分别与Q形成的共价化合物化学式为QY2、QZ4,则Y为-2价、Q为-1价,二者原子序数多大于Si,处于第三周期,则Y为S、Z为Cl,据此解答.
解答:解:Q、R、X、Y、Z为短周期元素,它们的原子序数依次增大.X在地壳中含量居第二位,则X为Si;Q与X同族,则Q为C;Q的低价氧化物为CO,与R单质分子中的电子总数相等,则R单质分子含有电子总数为14,结合原子序数可知R为N;Y、Z分别与Q形成的共价化合物化学式为QY2、QZ4,则Y为-2价、Q为-1价,二者原子序数多大于Si,处于第三周期,则Y为S、Z为Cl,
(1)同周期自左而右非金属性增强,非金属越强氢化物越稳定,故稳定性HCl>H2S>SiH4,
故答案为:HCl>H2S>SiH4;
(2)X为Si,处于周期表中第三周期ⅣA族,硅与氢氧化钠反应生成硅酸钠与氢气,反应离子方程式为:Si+2OH-+H2O═SiO32-+2H2↑,
故答案为:第三周期ⅣA族;Si+2OH-+H2O═SiO32-+2H2↑;
(3)R为N,其单质为N2,氮原子之间形成3对共用电子对,电子式为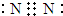 ,其氢化物为NH3,为三角锥型,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
,其氢化物为NH3,为三角锥型,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
4NO+6H2O,
故答案为: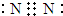 ;三角锥型;4NH3+5O2
;三角锥型;4NH3+5O2
4NO+6H2O;
(4)C与S形成的直线型分子CS2,与CO2结构类似,为直线型结构,正负电荷重心重合,属于非极性分子,故答案为:非极性.
(1)同周期自左而右非金属性增强,非金属越强氢化物越稳定,故稳定性HCl>H2S>SiH4,
故答案为:HCl>H2S>SiH4;
(2)X为Si,处于周期表中第三周期ⅣA族,硅与氢氧化钠反应生成硅酸钠与氢气,反应离子方程式为:Si+2OH-+H2O═SiO32-+2H2↑,
故答案为:第三周期ⅣA族;Si+2OH-+H2O═SiO32-+2H2↑;
(3)R为N,其单质为N2,氮原子之间形成3对共用电子对,电子式为
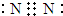 ,其氢化物为NH3,为三角锥型,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
,其氢化物为NH3,为三角锥型,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:
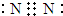 ;三角锥型;4NH3+5O2
;三角锥型;4NH3+5O2
| ||
| △ |
(4)C与S形成的直线型分子CS2,与CO2结构类似,为直线型结构,正负电荷重心重合,属于非极性分子,故答案为:非极性.
点评:本题考查考查物质结构性质关系应用,涉及元素周期律、常用化学用语、分子结构与性质等,难度不大,推断元素是关键,注意基础知识的掌握.

练习册系列答案
相关题目
 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]