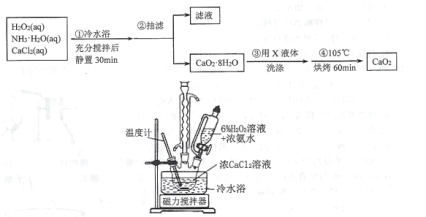
题目内容
【题目】Ⅰ.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga______As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为_____________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

Ⅱ.醋酸铜可合成复合材料石墨烯Cu,其制备原料为CuSO4、NH3·H2O和醋酸等。
(1)写出一种与SO42-互为等电子体的分子__________。
(2)二聚醋酸铜的结构示意图如图所示,Cu2+的配位数为___________。

(3)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为a nm该化合物中K原子和C60分子的个数比为______,该晶体的密度ρ=______g/cm3(列出计算式)。
【答案】1s22s22p63s23p63d104s24p3 大于 小于 三角锥形 sp3 GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高 原子晶体 共价键  ×100% CCl4 5 3:1 2.78/a3
×100% CCl4 5 3:1 2.78/a3
【解析】
Ⅰ.(1)As为ⅤA族33号元素;
(2)同一周期,原子序数越小半径越大,同周期第一电离能从左到右,逐渐增大;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,据此解答;
=4,据此解答;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρ gcm-3,根据均摊法计算。
Ⅱ.(1)SO42-有5个原子、价电子总数为32,据此判断;
(2)Cu2+与周围的5个O原子形成配位键;
(3)根据均摊法计算晶胞中K原子、C60分子数目,确定二者数目之比;计算晶胞中K原子、C60分子的总质量,再利用ρ=![]() 计算晶体密度。
计算晶体密度。
Ⅰ.(1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3;
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形;
=4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρ gcm-3,根据均摊法计算As:8×![]() +6×
+6×![]() =4,Ga:4×1=4,故其晶胞中原子所占的体积V1=(
=4,Ga:4×1=4,故其晶胞中原子所占的体积V1=(![]() πr3As×4+
πr3As×4+![]() πr3Ga×4)×10-30,晶胞的体积V2=
πr3Ga×4)×10-30,晶胞的体积V2=![]() =
= ,故GaAs晶胞中原子的体积占晶胞体积的百分率为
,故GaAs晶胞中原子的体积占晶胞体积的百分率为![]() ×100%将V1、V2带入计算得百分率=
×100%将V1、V2带入计算得百分率= ×100%;
×100%;
Ⅱ.(1)SO42-有5个原子、价电子总数为32,则与其等电子体的有CCl4;
(2)Cu2+与周围的5个O原子形成配位键,Cu2+的配位数为5;
(3)晶胞中K原子原子数目=12×![]() =2,化合物中K原子和C60分子的个数比为6:2=3:1;晶胞中K原子、C60分子的总质量=
=2,化合物中K原子和C60分子的个数比为6:2=3:1;晶胞中K原子、C60分子的总质量=![]() g,晶体密度=
g,晶体密度=![]() g÷(a×10-7)3=
g÷(a×10-7)3=![]() g/cm3。
g/cm3。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】昆明得天独厚的气候地理条件,造就了亚洲第一鲜花交易市场。生活中人们为了延长鲜花的寿命,通常会加入鲜花保鲜剂。
下表是0.25 L某种鲜花保鲜剂中含有的成分及含量(部分成分省略)。回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 12.50 | 342 |
硫酸钾(K2SO4) | 0.125 | 174 |
高锰酸钾(KMnO4) | 0.125 | 158 |
硝酸银(AgNO3) | 0.01 | 170 |
…… | …… | …… |
(1)鲜花保鲜剂的下列成分中,不属于电解质的是__________(填标号)。
a.C12H22O11 b.K2SO4 c.KMnO4 d.AgNO3
(2)欲配制250 mL该鲜花保鲜剂,现已提供下列仪器:①250mL容量瓶②量筒③烧杯④药匙⑤电子天平,如要完成实验,缺少的玻璃仪器还有_________、_________ (写仪器名称)。
(3)下列操作会使所配鲜花保鲜剂浓度偏低的是__________(填标号)。
a.容量瓶用蒸馏水洗净后没有烘干 b.用玻璃棒引流,将溶液转移到容量瓶中时有溶液洒到了容量瓶外面 c.定容时俯视刻度线 d.滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线
(4)写出该鲜花保鲜剂中K+的物质的量浓度的计算式(省略成分中不含K+)_______(不必化简)。