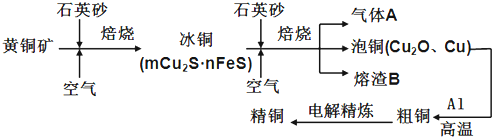
��Ŀ����
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
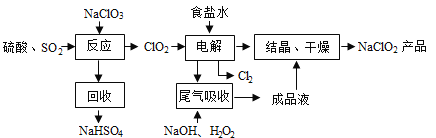
�ش��������⣺
��1������⡱����ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱΪ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�
Ϊ______��________��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ____________��
��3��ʵ������ԭ����������Ũ����ϡ�Ͷ���ã�д��ʵ�����_____________��
��4����β�����ա������ա���⡱�����ų�������ClO2�������շ�Ӧ�У��������뻹ԭ��������
����֮��Ϊ_______��
��5����lmol SO2��lmol Cl2ͨ��ˮ���γ�lL����Һ��������Һ��������Ũ��Ϊ_______mol/L��
���𰸡���1��NaOH��Na2CO3����2��2NaClO3+SO2+H2SO4=2NaHSO4+ClO2����
��3����Ũ���������ձ���������ע��ˮ������Ͻ�����4��2��1����5��4
��������
�������������ˮ����ʱΪ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�ΪNaOH��Na2CO3����2��NaClO3��SO2��H2SO4�ữ����������ClO2������NaClO2������������ԭ����ΪNaCl�����ݵ����غ��ԭ���غ㣬�˷�Ӧ�Ļ�ѧ����ʽΪ2NaClO3+SO2+H2SO4=2NaHSO4+ClO2������3��Ũ����ϡ�͵ķ����ǣ���Ũ���������ձ���������ע��ˮ������Ͻ��裬����Ũ��������ˮ���������������Һ�ηɽ�����4��ͼʾ��֪���ú��й��������NaOH��Һ��ԭClO2���壬����ΪNaClO2��������շ�Ӧ�У�������ΪClO2����ԭ����ΪNaClO2���ȵĻ��ϼ۴�+4�۽���Ϊ+3�ۣ���ԭ��ΪH2O2����������ΪO2����֪ÿĦ��H2O2ʧ2mol���ӣ����ݵ����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ2:1����5������SO2+C12+2H2O=2HCl+H2SO4��֪��������Һ��������Ũ��Ϊ4mol/L��

 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�