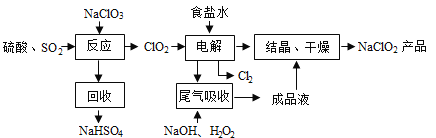
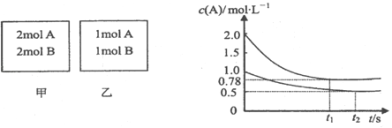
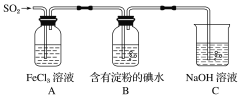
题目内容
【题目】下列有关物质结构的说法正确的是( )
A. 电子层数多的原子的半径一定大于电子层数少的原子的半径
B. P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C. H2SO3酸性强于H2CO3,所以非金属性S大于C
D. 不同原子形成的化合物中一定只含极性键
【答案】B
【解析】试题分析:A.同主族从上到下电子层数增多,原子半径增大,不是同主族电子层多半径不一定大;
B.P的最外层有5个电子,形成3个单键可达8电子稳定结构,S的最外层为6个电子,形成2个单键可达到8电子稳定结构,然后根据均摊法计算出P4S3分子中含有的共价键数目;
C.利用最高价含氧酸的酸性比较非金属性;
D.不同原子形成的共价键可能含非极性键.
解:A.同主族从上到下电子层数增多,原子半径增大,则同主族电子层数多的原子半径比电子层数少的大,不是同主族电子层多半径不一定大,如Li的半径大于Cl的半径,故A错误;
B.P4S3分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构,P原子最外层为5个电子,可形成3个共价键,根据均摊法,每个P原子形成的共价键数目为:![]() ×3=
×3=![]() ,4个P原子形成的共价键数目为
,4个P原子形成的共价键数目为![]() ×4=6;S原子最外层6个电子,可形成2个共价键,每个S原子可形成的共价键数目为
×4=6;S原子最外层6个电子,可形成2个共价键,每个S原子可形成的共价键数目为![]() ×2=1,3个S原子形成的共价键数目为:1×3=3,因此一个三硫化四磷分子中含有的共价键个数为6+3=9个,故B正确;
×2=1,3个S原子形成的共价键数目为:1×3=3,因此一个三硫化四磷分子中含有的共价键个数为6+3=9个,故B正确;
C.H2SO3酸性强于H2CO3,不能判断非金属性S大于C,因亚硫酸不是最高价含氧酸,故C错误;
D.不同原子形成的化合物中可能含非极性键,如H﹣O﹣O﹣H中含极性键、非极性键,故D错误;
故选B.

练习册系列答案
相关题目