题目内容
【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
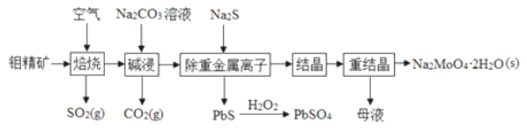
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。
【答案】N2 催化剂 44.8 190kJ D 0.25 升高温度
【解析】
本题考查化学平衡的计算;有关反应热的计算;化学平衡的影响因素.氧化还原反应中得失电子总数相等;反应热=反应物总键能﹣生成物总键能;分析化学平衡影响因素时,要分析反应特点即:反应热、方程式两边气体体积变化情况;反应速率等于单位时间内的浓度变化。
(1)由图1可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;V4+﹣O﹣H在反应前后不变,作催化剂;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:N2;催化剂;44.8;
(2)焓变=反应物总键能﹣生成物总键能,设断开1molN﹣N需要吸收的能量QkJ,则:Q+4×390+498﹣946﹣4×460=﹣538,解得Q=190;
故答案为:190kJ;
(3)①该反应是气体体积增大、正反应放热的反应,
A、增大压强,反应逆向移动,氨气的转化率减小,且压强增大化学反应速率增大,缩短反应到达平衡的时间,所以图象符合,故A不选;
B、催化剂加快反应速率,但不改变平衡,所以图象符合,故B不选;
C、增大压强,逆向移动,NO的产率降低,所以图象符合,故C不选;
D、升高温度,反应逆向移动,水蒸气的含量降低,所以图象不符合,故D选;
故答案为:D;
②0~4min内,v(O2)=![]() mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
故答案为:0.25;升高温度.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案