题目内容
19.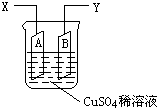 如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y.
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y.(1)当以IA的电流电解6min后,测得铜片A的质量减少了2.56g,则图装置中的X端应与直流电的正极相连.
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度0.5mol/L.溶液中H+的物质的量浓度为0.8mol/L.
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示)2.8I×1022mol-1.(已知电子电量e=1.60×10-19C)
分析 (1)A为纯铜片,电解过程中A的质量减少了2.56g,则A为阳极,与电解池阳极相连的为电源正极;(2)电解后将电源反接,X为阴极,2IA的电流电解6min后,反应生成铜的物质的量为:$\frac{2.56g}{64g/mol}$×2=0.08mol,则前3分钟相当于电镀,溶液中铜离子浓度不变;3min后开始电极硫酸铜溶液,溶液中铜离子减少了0.04mol,同时生成了0.08mol氢离子,根据c=$\frac{n}{V}$计算出铜离子减少的浓度,从而可知原溶液中铁离子浓度;根据电子守恒计算出电解后溶液中氢离子的物质的量及浓度;
(3)每生成1mol Cu,需要转移2mole-,现生成0.08mol Cu,需转移0.16mole-,
由物理学知识知,体系中通过的电子的物质的量为:n(e-)=$\frac{Q}{{N}_{A}•{e}^{-}}=\frac{It}{{N}_{A}•{e}^{-}}=\frac{2IA×6×60s}{1.6×1{0}^{-19}C•{N}_{A}}$=0.16mol,据此计算出阿伏伽德罗常数NA.
解答 解:(1)A为纯铜片,电解过程中A的质量减少了2.56g,则A为阳极,与A相连的X端为电源的正极,
故答案为:正极;
(2)电解后将电源反接,X为阴极,2IA的电流电解6min后,反应生成铜的物质的量为:$\frac{2.56g}{64g/mol}$×2=0.08mol,则前3分钟相当于电镀,溶液中铜离子浓度不变;3min后开始电极硫酸铜溶液,溶液中铜离子减少了0.04mol,同时生成了0.08mol氢离子,铜离子减少的浓度为:$\frac{0.04mol}{0.1L}$=0.4mol/L,则原溶液中铜离子的浓度为:0.1mol/L+0.4mol/L=0.5mol/L;后3分钟阳极氢氧根离子失去电子生成氧气:4OH--4e-=2H2O+O2↑,根据电子守恒,生成氢离子的物质的量为:n(H+)=n放电(OH-)=n(e-)=2n(Cu)=0.08mol,则溶液中氢离子浓度为:$\frac{0.08mol}{0.1L}$=0.8mol/L,
故答案为:0.5;0.8;
(3)每生成1mol Cu,需要转移2mole-,现生成0.08mol Cu,需转移0.16mole-,
由物理学知识知,体系中通过的电子的物质的量为:n(e-)=$\frac{Q}{{N}_{A}•{e}^{-}}=\frac{It}{{N}_{A}•{e}^{-}}=\frac{2IA×6×60s}{1.6×1{0}^{-19}C•{N}_{A}}$=0.16mol,
则:NA=$\frac{2IA×6×60s}{1.6×1{0}^{-19}C×0.16mol}$=2.8I×1022mol-1,
故答案为:2.8I×1022.
点评 本题考查了阿伏伽德罗常数的测定,题目难度中等,明确电解原理为解答关键,注意掌握测定阿伏伽德罗常数的方法,试题培养了学生的分析能力及化学实验、化学计算能力.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 测得0.1 mol/L氨水中c(OH-)为10-3 mol•L-1:NH3•H2O?NH4++OH- | |
| C. | 在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| A. | 金属铜 | B. | 碘 | C. | 固体氮 | D. | 硫酸钠 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,甲中和丙中H2的转化率均是60% | |
| B. | 平衡时,丙中c(CO2)是0.012 mol/L | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
| A. | 催化剂只改变正反应速率的速率 | |
| B. | 催化剂能够改变反应的反应热 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过降低反应的活化能来加快反应速率 |
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)△H=-1311.7kJ.mol-1
(2)一定温度下,将N2H4与N02以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)
下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时v正>v逆.
(1)已知反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应中的a大于0(填“大于”、“小于”或“等于”).
③若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为1mol?L-1.
④700℃反应达到平衡,此时增大反应中CO的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和CO2的体积比值不变(填“增大”、“减小”或“不变”).
(2)工业固氮反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol?L-1.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数.