题目内容
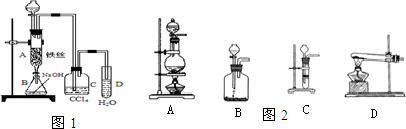
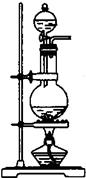
(1)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
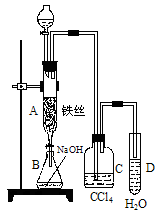
①写出A中有机反应的化学方程式
___________________________________________________
②已知上述有机反应是放热反应。观察到A中的现象是
_____________________及______________________。
③ 实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________________________________________,写出有关的化学方程式____________________________________________。
④C中盛放CCl4的作用是______________________________________。
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。
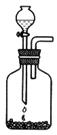
(2)乙炔的实验室制法
①反应原理___________________________________________________。
②选择合适的制取实验装置_______。

 |  | ||
A B C D
③实验中常用饱和食盐水代替水,目的是___________________________________。
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味。可以用________________溶液除去杂质气体。
(1)⑴ C6H6 +Br2 C6H5Br + HBr
⑵ 反应液微沸 有红棕色气体充满A容器
⑶ 除去溶于溴苯中的溴 Br2+2NaOH
⑷ 除去溴化氢气体中的溴蒸气
⑸ 石蕊试液,溶液变红色
(2)①略 ②B ③减缓电石与水的反应速率 ④硫酸铜