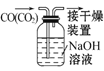
题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
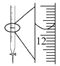
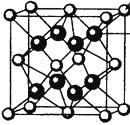
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】1s22s22p63s1或[Ne]3s1 Cl H2S分子间不存在氢键,H2O分子间存在氢键 平面三角形 Na+ K2Cr2O7+3H2O2+ 4H2SO4=K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】
M元素的2p电子数是2s的2倍,故价电子排布应为2s22p4,M为氧元素。R的原子序数比氧大,又是短周期金属,故只能是第三周期。第三周期最活泼的金属是钠。X与M的化合物,引起酸雨,只有可能是二氧化硫或氮氧化物。但是X的原子序数比氧大,故X只能是硫元素。Y的原子序数比X大,又是短周期元素,只能是氯元素。Z的最高价含氧酸的钾盐是橙色,这是重铬酸盐的典型颜色。题目中关于4s、3d轨道半充满的描述,也能推出Z是铬元素(3d54s1)。
(1)钠元素的基态电子排布为1s22s22p63s1,同周期元素从左到右电负性增大,Cl的电负性比S大。
(2)H2O之间有氢键,而H2S之间没有氢键。分子间氢键会导致化合物熔沸点升高。
(3)对于SO3分子,价电子对数为3,孤电子对数为![]() ,所以分子应该是平面三角形。
,所以分子应该是平面三角形。
(4)R2M为Na2O。晶胞中黑球全部在晶胞内部,故有8个,白球有![]() 个,二者比例为2:1。故黑球为Na+。
个,二者比例为2:1。故黑球为Na+。
(5)水的化学性质稳定,不会与重铬酸钾反应,被氧化的M的氢化物只能是H2O2,氧化产物是O2。根据题目,还原产物中Cr为+3价,反应又在稀硫酸中进行,故还原产物为Cr2(SO4)3。根据元素守恒,另两个产物是K2SO4和H2O。该反应的化学方程式是K2Cr2O7+3H2O2+ 4H2SO4 =K2SO4+Cr2(SO4)3+3O2↑+7H2O。

【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。
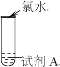
【题目】由下述实验现象,下列氯水对应结论不正确的是
实验 | 装置 | 试剂 A | 现象 |
① |
| 紫色石蕊溶液 | 先变红后褪色 |
② | 滴有 KSCN 的 FeCl2 溶液 | 溶液变红 | |
③ | NaHCO3 溶液 | 产生使澄清石灰水变浑浊的气体 | |
④ | HNO3 酸化的 AgNO3 溶液 | 产生白色沉淀 |
A.①氯水具有酸性和漂白性
B.②氯水具有还原性
C.③氯水中含有 H+
D.④氯水中含有 Cl-