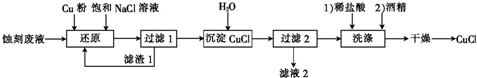
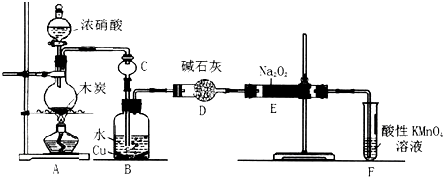
题目内容
7.根据反应Fe+2HCl=FeCl2+H2;2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,氧化性Cl2>HCl.分析 根据氧化还原反应中,将金属氧化到的价态越高的氧化剂的氧化性越强.
解答 解:反应Fe+2HCl=FeCl2+H2↑中盐酸是氧化剂,将金属铁氧化为+2价,反应2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3中,氯气是氧化剂,能将金属铁氧化为+3价,将铁氧化到的价态越高,所以氧化剂的氧化性越强,即氧化性:Cl2>HCl,故答案为:Cl2;HCl.
点评 本题考查学生氧化剂的氧化性强弱的判断方法,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列常见金属的冶炼原理不正确的是( )
| A. | Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | B. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | ||
| C. | 2AlCl3$\frac{\underline{\;通电\;}}{\;}$2Al+3Cl2↑ | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
12.等质量的过量金属投入到100mL 1mol•L-1的盐酸中,放出气体最多的是( )
| A. | Al | B. | Zn | C. | Fe | D. | Na |
19.下列条件下,两种气体的分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的CO和C2H4 | |
| C. | 相同温度、相同压强、相同体积的O2和N2 | |
| D. | 相同压强、相同体积、相同质量的NO2和N2O5 |
16.下列各组离子方程式正确的是( )
| A. | Cu(OH)2与稀HNO3混合:OH-+H+═H2O | |
| B. | CaCl2与Na2CO3反应:Ca2++CO32-═CaCO3↓ | |
| C. | MgSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | Fe2O3溶于稀HNO3:Fe2O3+6H+═2Fe3++3H2O |