题目内容
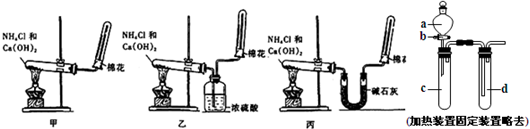
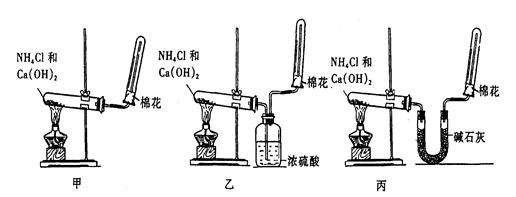
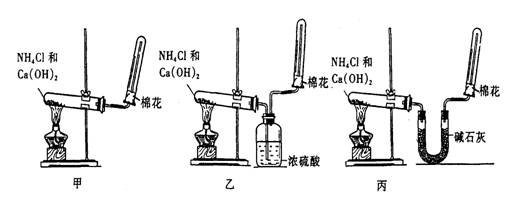
为了实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)
(2)写出制取氨气的化学方程式
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)?
分析:(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气为碱性气体,应用碱石灰干燥;
(2)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑
(3)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验;
(2)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
| ||
(3)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验;
解答:解:(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气为碱性气体,应用碱石灰干燥,甲中不能得到干燥的氨气,乙中浓硫酸和氨气反应得不到氨气,丙中氨气通过碱石灰干燥用向下排气法可以收集到干燥的氨气;
故答案为:丙;
(2)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
(3)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,
故答案为:用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
故答案为:丙;
(2)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
(3)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,
故答案为:用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
点评:本题考查氨的实验探究,题目难度中等,注意实验室制备氨气的所用药品,氨气的检验方法.

练习册系列答案
相关题目
实验室里为了简便制取干燥的氨气,下列方法中合适的是( )
| A、在浓氨水中加入NaOH固体并加热,产生的气体用碱石灰干燥 | B、加热NH4Cl固体,产生的气体用碱石灰干燥 | C、在N2和H2混合气体中加入铁触媒并加热至500℃ | D、加热NH4HCO3固体,生成的气体用P2O5干燥 |