题目内容
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
H4=________kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:![]()
该反应在一定条件下能自发进行的原因是_______;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
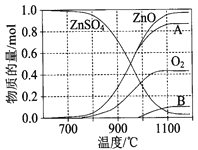
①写出700℃~980℃时发生反应的化学方程式:______________________________________________, 物质B的化学式是________________。
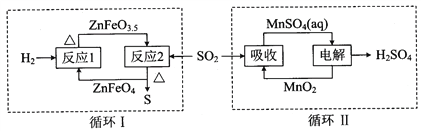
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:_____________________________________________;循环II中电解过程阳极反应式是_________________________________________。
【答案】 -377.5 △H<0 bd 2ZnSO4![]() 2ZnO+2SO2↑+O2↑ SO2 4ZnFeO3.5+SO2
2ZnO+2SO2↑+O2↑ SO2 4ZnFeO3.5+SO2![]() 4ZnFeO4+S Mn2+-2e-+2H2O=MnO2+4H+
4ZnFeO4+S Mn2+-2e-+2H2O=MnO2+4H+
【解析】(1)① 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) △H1=-930 kJ·mol-1
②2C(s) + O2(g) = 2CO(g) △H2=-221 kJ·mol-1
③ZnO(s) + CO(g) = Zn(g) + CO2(g) △H3=198kJmol-1
根据盖斯定律,将方程式(①+②)÷2+③得ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g),△H4=(―930 kJ·mol-1―221 kJ·mol-1)÷2+198kJmol-1=-377.5kJmol-1;当△G=△H-T△S<0时反应一定能自发进行,因反应![]() 的△S<0,则焓变应该小于0;a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.因CO(NH2)2是固体,反应前后气体的密度改变,所以当容器中混合气体的密度不再改变时,该反应达到平衡状态,故d正确;故答案为:-377.5;△H<0;bd;
的△S<0,则焓变应该小于0;a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.因CO(NH2)2是固体,反应前后气体的密度改变,所以当容器中混合气体的密度不再改变时,该反应达到平衡状态,故d正确;故答案为:-377.5;△H<0;bd;
(2). ①. 据图可知,700℃~980℃发生反应时,生成ZnO、氧气和B,根据原子守恒可知,B中含有S原子,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件可得反应方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4
2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑;SO2;
2ZnO+2SO2↑+O2↑;SO2;
②. ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,反应方程式为4ZnFeO3.5+SO2 ![]() 4ZnFeO4+S;电解硫酸锰时,生成二氧化锰和硫酸,Mn2+在阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:4ZnFeO3.5+SO2
4ZnFeO4+S;电解硫酸锰时,生成二氧化锰和硫酸,Mn2+在阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:4ZnFeO3.5+SO2 ![]() 4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+。
4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+。
