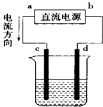
��Ŀ����
����Ŀ���Ȼ�������SO2Cl2����Ҫ�����Ȼ���������һ����ɫҺ�壬�۵���54.1�����е�69.1������ˮ����������Ȼ��⡣�Ȼ��������ø���Ķ�������������ڻ���̿���������·�Ӧ��ȡ��SO2(g)+Cl2(g)![]() SO2Cl2(l) ��H= -97.3kJ/mol
SO2Cl2(l) ��H= -97.3kJ/mol
��1��Ϊ�����������Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ��������______����д�������
A����С������� B��ʹ�ô��� C������SO2Ũ�� D�������¶�
��2����֪20��ʱ��AgCl���ܽ��Ϊ0.00015 g��Ag2SO4���ܽ��Ϊ0.796 g����SO2Cl2����ˮ������Һ����μ���AgNO3ϡ��Һʱ�����Ȳ����ij�����____________��
��3��300��ʱ�����Ϊ1L���ܱ������г���a mol SO2Cl2���ﵽƽ��ʱ�����к�SO2 b mol����300��ʱ�ϳ�SO2Cl2��Ӧ��ƽ�ⳣ��Ϊ_____________��
��4������3�����õ�ƽ����������������BaCl2��Һ�У������������ɳ�����������д��������̣�________
���𰸡� AC AgCl ![]() ��SԪ�������غ㣬�ɵã�n(BaSO4)= a mol��m(BaSO4)= a mol��233g/mol=233 a g
��SԪ�������غ㣬�ɵã�n(BaSO4)= a mol��m(BaSO4)= a mol��233g/mol=233 a g
��������(1). A����С���������ѹǿ����ƽ��������Ӧ�����ƶ���Cl2��ƽ��ת��������A��ȷ��B��ʹ�ô������ܹ����̴ﵽƽ���ʱ�䣬��ƽ�ⲻ�ƶ���Cl2��ƽ��ת���ʲ��䣬��B����C������SO2Ũ�ȣ�ƽ��������Ӧ�����ƶ���Cl2��ƽ��ת��������C��ȷ��D��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���Cl2��ƽ��ת���ʽ��ͣ���D����ѡAC��
(2). �Ȼ������ܽ��ԶС��Ag2SO4���ܽ�ȣ�SO2Cl2����ˮ������Һ��c��H2SO4��:c��HCl��=1:2����Һ��������Ũ��Ϊ���������Ũ�ȵ�2������AgCl���ȳ������ʴ�Ϊ��AgCl��
(3). ���������Ϊ1L��300��ʱ��SO2Cl2�����������ݷ�Ӧ����ʽSO2Cl2��g��![]() SO2��g��+Cl2��g�����������ʽ���У�
SO2��g��+Cl2��g�����������ʽ���У�
SO2Cl2��g��![]() SO2��g��+Cl2��g��
SO2��g��+Cl2��g��
��ʼ(mol/L) a 0 0
ת��(mol/L) b b b
ƽ��(mol/L) a��b b b
��300��ʱ��ӦSO2Cl2��g��![]() SO2��g��+Cl2��g����ƽ�ⳣ��Ϊ��K=
SO2��g��+Cl2��g����ƽ�ⳣ��Ϊ��K=![]() =
=![]() ����ϳ�SO2Cl2�ķ�Ӧ��SO2Cl2��g��
����ϳ�SO2Cl2�ķ�Ӧ��SO2Cl2��g��![]() SO2��g��+Cl2��g�����淴Ӧ����ϳ�SO2Cl2��Ӧ��ƽ�ⳣ��Ϊ��
SO2��g��+Cl2��g�����淴Ӧ����ϳ�SO2Cl2��Ӧ��ƽ�ⳣ��Ϊ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
(4). ����3�����õ�ƽ����������������BaCl2��Һ�У�������Ӧ��SO2Cl2+2H2O�TH2SO4+2HCl��SO2+Cl2+2H2O�TH2SO4+2HCl��H2SO4+BaCl2�TBaSO4��+2HCl��SO2Cl2�����ʵ���Ϊamol����SԪ�������غ�ɵ�n��BaSO4��=n��SO2Cl2��=amol�������ᱵ������Ϊ��amol��233g/mol=233a g���ʴ�Ϊ����SԪ�������غ㣬�ɵã�n(BaSO4)= a mol��m(BaSO4)= a mol��233g/mol=233 a g��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�