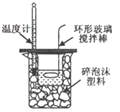
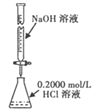
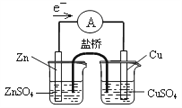
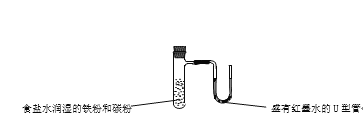
��Ŀ����
����Ŀ������ƽ����ϵ��a A(g)+b B(g)![]() c C(g)+d D(s) ��H��0�������ж�����ȷ����
c C(g)+d D(s) ��H��0�������ж�����ȷ����
A. ��(a+b) �� (c+d)����Ӧһ�����Է����ҽ���
B. ����ʼʱֻ����A��B�������ʵ���֮��Ϊa��b����ƽ��ʱA��B��ת����֮��Ϊa��b
C. ��a+b = c+d������m mol�����ƽ����ϵ�г���n mol B����ﵽƽ��ʱ���������ʵ������ڣ�m+n��mol��
D. ��a+b = c�������������������������¶ȣ�ƽ�������ƶ��������������ѹǿ����
���𰸡�D
��������A. DΪ��������(a+b)<(c+d)�����S��һ������0������G=��HT��S<0ʱ����Ӧ�����Է����У���A����B. ����ʼʱֻ����A��B����A��B�����ʵ���֮��Ϊa:b�����ݷ�Ӧ����ʽ��֪����Ӧ����������A��B�����ʵ���֮��Ҳ��a:b����ƽ��ʱA. B��ת����֮��Ϊ1:1����B����C. DΪ�������������г���n molB��ƽ��������Ӧ�����ƶ�������������ʵ�����С����ﵽƽ��ʱ���������ʵ���С��(m+n)mol����C����D. �÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���a+b=c����Ӧǰ���������ʵ������䣬�ں��������£��¶�Խ��ѹǿԽ���������¶������������ѹǿ����D��ȷ����ѡD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�