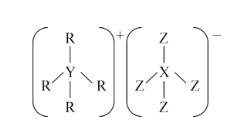题目内容
【题目】R元素无同位素。21gR2+金属离子内含有22×3.01×1023个中子,取等质量的该元素单质与酸反应,在标准状况下生成11.2LH2。
(1)21g R2+金属阳离子中含有_________mol质子?_________________mol电子?
(2)R是__________元素?写出该元素原子核的组成_______________?
【答案】10mol 9mol Ca元素 ![]()
【解析】
先求出R原子的质量数,再根据中子数求质子数,进而判断元素类别。
由题意可知21gR2+原子内含11mol中子,取等质量的该元素单质与酸反应放出0.5molH2,设R的摩尔质量为M,则列式:
R![]() H2
H2
![]() ,解得:M=42g/mol,21gR为0.5mol,含有质子和中子共有21mol。R2+与R的质子数、中子数均相等,R2+比R少2mol电子,可知21g(0.5mol)R2+含有质子10mol,电子9mol。答案:10mol; 9mol;
,解得:M=42g/mol,21gR为0.5mol,含有质子和中子共有21mol。R2+与R的质子数、中子数均相等,R2+比R少2mol电子,可知21g(0.5mol)R2+含有质子10mol,电子9mol。答案:10mol; 9mol;
(2)由上述分析可知0.5molR2+含有质子数10mol,则1molR含有质子数为20mol,所以R为Ca元素,该元素原子核的组成为![]() ,答案:Ca元素;
,答案:Ca元素;![]() 。
。

 每日10分钟口算心算速算天天练系列答案
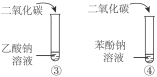
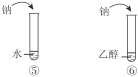
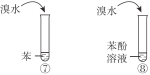
每日10分钟口算心算速算天天练系列答案【题目】下列实验内容能达到实验目的的是
实验目的 | 实验内容 | |
A | 鉴别乙醇与乙醛 |
|
B | 比较乙酸、碳酸、苯酚的酸性 |
|
C | 说明烃基对羟基上氢原子活性的影响 | |
D | 说明苯环对取代基上氢原子活性的影响 |
|
A. AB. BC. CD. D
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
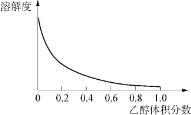
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。