题目内容
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
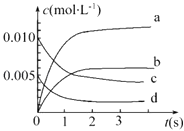
(1)上述反应在第5s时,NO的转化率为 .
(2)如图中表示NO2变化曲线的是 . 用O2表示0~2s内该反应的平均速率v= .
(3)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
【答案】
(1)65%
(2)b;0.0015mol?L﹣1?S﹣1
(3)bc
【解析】解:(1)从表中可知5s时,一氧化氮的物质的量为0.007mol,一氧化氮起始物质的量为0.020mol,则NO的转化率= ![]() ×100%=
×100%= ![]() =65%,
=65%,
所以答案是:65%;
(2.)根据一氧化氮物质的量的变化知,一氧化氮的物质的量在减少,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,图象的纵坐标代表浓度,所以表示NO2的变化的曲线是b,
0~2s内v(NO)= ![]() ÷2min=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(Ls),
÷2min=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(Ls),
所以答案是:b,0.0015mol/(Ls);
(3.)a.无法判断正逆反应速率是否相等,故a错误;
b.反应前后气体体积不同,压强不变说明气体总物质的量不变,各组分物质的量不变,达到平衡,故b正确;
c.v逆(NO)=2v正(O2)时,说明正逆反应速率相等,反应达到平衡状态,故c正确;
d.恒容容器,反应物生成物都是气体质量不变,所以密度始终不变,密度不变说明不一定达到平衡,故d错误;
所以答案是:bc.
【考点精析】掌握化学平衡状态的判断是解答本题的根本,需要知道状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案