题目内容
下表为部分短周期元素化合价及相应氢化物沸点的数据:
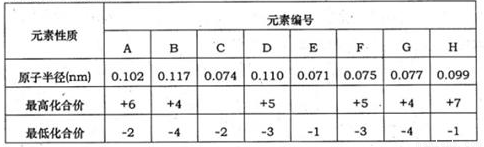
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是
(2)写出H的最高价氧化物的电子式:
 ,比较A、D、G三种简单阴离子的半径大小:
,比较A、D、G三种简单阴离子的半径大小:
r(
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:BD+BD2+Na2CO3=2
①横线上某盐的化学式应为
(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,标出必要的说明即可
 .
.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
请回答:
(1)表中属于第三周期元素的是
ACEG
ACEG
(用表中元素编号填写).(2)写出H的最高价氧化物的电子式:


r(
S2-
S2-
)>r(Cl-
Cl-
)>r(O2-
O2-
) (用元素符号表示)(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
ab
ab
.a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:
SOCl2+H2O=SO2+2HCl
SOCl2+H2O=SO2+2HCl
.(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:BD+BD2+Na2CO3=2
NaNO2
NaNO2
+CO2①横线上某盐的化学式应为
NaNO2
NaNO2
;②每产生44.8L(标准状况)CO2,被吸收尾气的质量是152
152
g.(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,标出必要的说明即可


分析:A与D可形成化合物AD2、AD3,结合元素的化合价可知,A为S,D为O,B、E均在第ⅤA族,E的氢化物的沸点高,与D可形成化合物BD、BD2,可用于制备强酸乙,则B为N,E为P;C、H均在ⅣA族,由氢化物的沸点可知,C为Si,H为C;F、G均在ⅤⅡA,F的沸点高,F为F元素,G为Cl,
(1)根据元素的位置分析第三周期元素;
(2)H的最高价氧化物为二氧化碳,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
(3)过氧化氢分解一般使用催化剂来加快反应速率;
(4)ADG2的物质为SOCl2,由信息可知生成二氧化硫和盐酸;
(5)根据质量守恒定律及方程式来计算;
(6)设计为电解池,Cu作阳极可实现Cu与稀硫酸的反应.
(1)根据元素的位置分析第三周期元素;
(2)H的最高价氧化物为二氧化碳,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
(3)过氧化氢分解一般使用催化剂来加快反应速率;
(4)ADG2的物质为SOCl2,由信息可知生成二氧化硫和盐酸;
(5)根据质量守恒定律及方程式来计算;
(6)设计为电解池,Cu作阳极可实现Cu与稀硫酸的反应.
解答:解:A与D可形成化合物AD2、AD3,结合元素的化合价可知,A为S,D为O,B、E均在第ⅤA族,E的氢化物的沸点高,与D可形成化合物BD、BD2,可用于制备强酸乙,则B为N,E为P;C、H均在ⅣA族,由氢化物的沸点可知,C为Si,H为C;F、G均在ⅤⅡA,F的沸点高,F为F元素,G为Cl,
(1)由以上元素的可知,ACEG在第三周期,故答案为:ACEG;
(2)H的最高价氧化物为二氧化碳,其电子式为 ,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为:
,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为: ;
;
S2-;Cl-;O2-;
(3)催化剂具有专一性,过氧化氢分解一般使用二氧化锰或氯化铁作催化剂来加快反应速率,故答案为:ab;
(4)ADG2的物质为SOCl2,由信息可知生成二氧化硫和盐酸,该反应为SOCl2+H2O=SO2+2HCl,故答案为:SOCl2+H2O=SO2+2HCl;
(5)由质量守恒定律及氧化还原反应可知,NO+NO2+Na2CO3=2NaNO2+CO2,n(CO2)=2mol,
则被吸收尾气的质量为2mol×30g/mol+2mol×46g/mol=152g,故答案为:NaNO2;NaNO2;152;
(6)设计为电解池,Cu作阳极可实现Cu与稀硫酸的反应,该装置为 ,故答案为:
,故答案为: .
.
(1)由以上元素的可知,ACEG在第三周期,故答案为:ACEG;
(2)H的最高价氧化物为二氧化碳,其电子式为
 ,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为:
,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为: ;
;S2-;Cl-;O2-;
(3)催化剂具有专一性,过氧化氢分解一般使用二氧化锰或氯化铁作催化剂来加快反应速率,故答案为:ab;
(4)ADG2的物质为SOCl2,由信息可知生成二氧化硫和盐酸,该反应为SOCl2+H2O=SO2+2HCl,故答案为:SOCl2+H2O=SO2+2HCl;
(5)由质量守恒定律及氧化还原反应可知,NO+NO2+Na2CO3=2NaNO2+CO2,n(CO2)=2mol,
则被吸收尾气的质量为2mol×30g/mol+2mol×46g/mol=152g,故答案为:NaNO2;NaNO2;152;
(6)设计为电解池,Cu作阳极可实现Cu与稀硫酸的反应,该装置为
 ,故答案为:
,故答案为: .
.点评:本题考查元素周期表及元素周期律,难度较大,熟悉元素及其单质、化合物的性质是解答本题的关键.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题: