题目内容
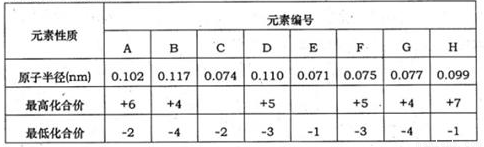
下表为部分短周期元素的原子半径及其主要化合价,
|
分析:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,T和R的最低化合价相同,应位于相同主族,可知R为S元素,L、Q只有正价,原子半径L>M,且原子半径大于R,可知应为第三周期元素,则L为Mg元素,M为Al元素,结合对应单质化合物的性质以及元素周期律的递变规律可解答该题.
解答:解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,T和R的最低化合价相同,应位于相同主族,可知R为S元素,L、Q只有正价,原子半径L>M,且原子半径大于R,可知应为第三周期元素,则L为Mg元素,M为Al元素,
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.M与T形成的化合物是氧化铝,是两性氧化物,故C正确;
D.金属性Mg比Al强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>M,故D错误.
故选C.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.M与T形成的化合物是氧化铝,是两性氧化物,故C正确;
D.金属性Mg比Al强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>M,故D错误.
故选C.
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,难度中等.

练习册系列答案
相关题目


 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题: