题目内容
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
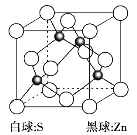
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
【答案】![]() Zn失去第二个电子达到3d10稳定结构,而Cu失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于H2S(或从电负性角度分析,合理即可) V 形
Zn失去第二个电子达到3d10稳定结构,而Cu失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于H2S(或从电负性角度分析,合理即可) V 形 ![]() 吡咯分子间存在氢键,噻吩分子间没有氢键 6
吡咯分子间存在氢键,噻吩分子间没有氢键 6 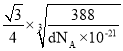
【解析】
(1)(2)主要考查核外电子排布规律, 元素的电离能主要与原子的核外电子排布有关系;
(3)考查分子的键长、键角。键长主要与成键原子的半径有关系,原子半径越大,键长越长;键角主要与电子对的斥力有关系,在同构型的分子中,还要考虑成键电子对及中心原子半径的影响;
(4)![]() 的空间构型,可先从电子式入手,写出正确的电子式,再结合中间S原子的孤电子对,可以推出它的空间构型为V型;
的空间构型,可先从电子式入手,写出正确的电子式,再结合中间S原子的孤电子对,可以推出它的空间构型为V型;
(5)①题中已经告知大π键的写法,据此答题即可;
②吡咯分子中含有N原子,其沸点比噻吩分子高,一定是受氢键的影响;
(6)本题主要考查晶胞结构的计算,需要注意题目的问法。
(1)S原子的价电子排布式为3s23p4,则其价电子的排布图为![]() ;(2)Cu的核外电子排布为1s22s22p63s23p63d104s1,Zn的核外电子排布为1s22s22p63s23p63d104s2,Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构,所以I2(Cu)>I2(Zn);
;(2)Cu的核外电子排布为1s22s22p63s23p63d104s1,Zn的核外电子排布为1s22s22p63s23p63d104s2,Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构,所以I2(Cu)>I2(Zn);
(3)H2O分子中的键长比H2S中的键长短,因为O的原子半径比S的小;氧原子半径小于硫,水分子中成键电子对之间排斥力大于 H2S;
(4)![]() 的电子式为:
的电子式为:![]() ,由于中心S原子含有两对孤电子,所以该离子的空间构型为V形;
,由于中心S原子含有两对孤电子,所以该离子的空间构型为V形;
(5)①噻吩分子的大π键由5个原子构成,参与形成大π键的电子数有6个,故噻吩的大π键可表示为![]() ;
;
②吡咯含有N原子,故其分子间存在氢键,噻吩分子间没有氢键,所以吡咯的沸点高一些;1mol吡咯,含有1mol N-H键,2mol N-C键,1mol C-C键,2mol C=C键,所以1mol吡咯含有6mol σ键;
(6)该晶胞中,S2-有![]() =4个,Zn2+有1×4个,则该晶胞含有4个ZnS,设晶胞的棱长为a nm,则有
=4个,Zn2+有1×4个,则该晶胞含有4个ZnS,设晶胞的棱长为a nm,则有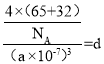 ,解得a=
,解得a= nm,由于1个Zn2+周围有4个S2-,且形成了边长为
nm,由于1个Zn2+周围有4个S2-,且形成了边长为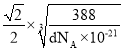 nm的正四面体,所以Zn2+与S2-的最短核间距为:
nm的正四面体,所以Zn2+与S2-的最短核间距为: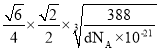 =
=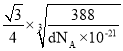 nm
nm