题目内容
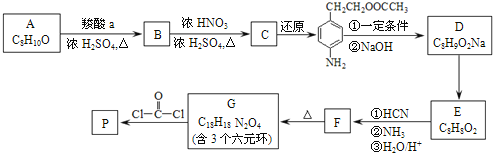
【题目】可降解聚合物 P 的合成路线如图:
已知: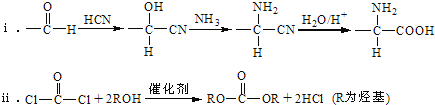 .
.
(1)A的含氧官能团名称是______。
(2)羧酸a的电离方程式是______。
(3)B→C的化学方程式是______。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是______。
(5)E→F中反应①和②的反应类型分别是______、______。
(6)F的结构简式是______。
(7)G→聚合物P的化学方程式是______。
【答案】羟基 CH3COOH![]() CH3COO-+H+
CH3COO-+H+ ![]() +HNO3
+HNO3![]() +H2O
+H2O ![]() 加成反应 取代反应
加成反应 取代反应 ![]() n
n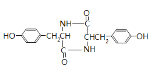 +n
+n![]() →
→![]() +(n-1)HCl。
+(n-1)HCl。
【解析】
由C还原产物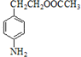 的结构,可知C为
的结构,可知C为![]() ,逆推可知B为
,逆推可知B为![]() ,结合A的分子式,可知A为
,结合A的分子式,可知A为![]() ,则羧酸a为CH3COOH;
,则羧酸a为CH3COOH;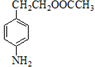 转化得到D,D转化得到E,结合反应信息i可知E中含有-CHO。化合物D苯环上的一氯代物有2种,结合D的分子式、C还原产物结构,可知D的结构简式为
转化得到D,D转化得到E,结合反应信息i可知E中含有-CHO。化合物D苯环上的一氯代物有2种,结合D的分子式、C还原产物结构,可知D的结构简式为![]() ,则E为
,则E为![]() ,E发生一系列反应生成F,根据题给信息知,F的结构简式为:
,E发生一系列反应生成F,根据题给信息知,F的结构简式为:![]() ,F加热得到G,结合G的分子式与结构特点,可知2分子F脱去2分子水生成G为
,F加热得到G,结合G的分子式与结构特点,可知2分子F脱去2分子水生成G为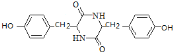 ,G与
,G与![]() 发生信息ii中反应得到高聚物P为
发生信息ii中反应得到高聚物P为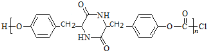 。
。
(1)A的结构简式为:![]() ,含有的官能团是羟基,故答案为:羟基;
,含有的官能团是羟基,故答案为:羟基;
(2)羧酸a为CH3COOH,电离方程式为:CH3COOH![]() CH3COO-+Hspan>+,故答案为:CH3COOH
CH3COO-+Hspan>+,故答案为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
(3)在浓硫酸作催化剂、加热条件下,B和浓硝酸发生取代反应生成C,该反应方程式为:![]() +HNO3
+HNO3![]() +H2O,
+H2O,
故答案为:![]() +HNO3
+HNO3![]() +H2O;
+H2O;
(4)化合物D苯环上的一氯代物有2种,结合D的分子式、C还原产物结构,可知D的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)通过题给信息知,E→F中反应①和②的反应类型分别是加成反应、取代反应,故答案为:加成反应、取代反应;
(6)D的结构简式为![]() ,则E为
,则E为![]() ,E发生一系列反应生成F,根据题给信息知,F的结构简式为:
,E发生一系列反应生成F,根据题给信息知,F的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
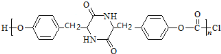
(7)F加热得到G,结合G的分子式与结构特点,可知2分子F脱去2分子水生成G为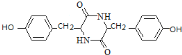 ,G与
,G与![]() 发生信息ii中反应得到高聚物P为
发生信息ii中反应得到高聚物P为![]() ,G→聚合物P的化学方程式是n
,G→聚合物P的化学方程式是n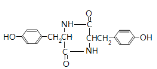 +n
+n![]() →
→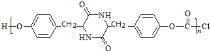 +(n-1)HCl。故答案为:n
+(n-1)HCl。故答案为:n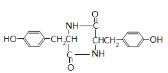 +n
+n![]() →
→ +(n-1)HCl。
+(n-1)HCl。

 阅读快车系列答案
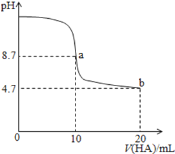
阅读快车系列答案【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
反应I(热裂解):CH3COOH(g)2CO(g)+2H2(g) △H1
反应II(脱羧基):CH3COOH(g)CH4(g)+CO2(g) △H2
已知:反应I的活化能为(E5-E2)kJ,反应I逆反应的活化能为(E5-E3)kJ,反应II的活化能为(E4-E2)kJ,反应II逆反应的活化能为(E4-E1)kJ,E1到E5能量依次增大
(1)△H1+△H2=___________kJ/mol (用有关E的代数式表示);
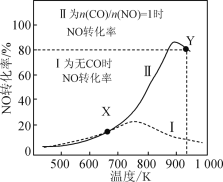
(2)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图所示:

①约650℃之前,氢气产率低于甲烷的原因是;________________________________;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:___________;(填编号)
a. 反应II速率减慢
b. 反应I速率加快的程度比反应II大
c. 反应I正向移动,而反应II逆向移动
d. 反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:______________。
(3)投入一定量的乙酸,在相同压强下,经过相同反应时间测得如下实验数据:
温度(℃) | 催化剂 | CH3COOH转化率 | H2的选择性 |
550 | 甲 | 14.5 | 40.2 |
550 | 乙 | 11.1 | 62.1 |
600 | 甲 | 11.2 | 41.2 |
600 | 乙 | 10.3 | 63.3 |
(H2的选择性:转化的CH3COOH中生成H2的百分比)
①表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成H2的选择性有显著的影响,其原因是________。
②有利于提高CH3COOH转化为H2平衡转化率的措施有________。
A.使用催化剂甲 B.使用催化剂乙
C.升高反应温度 D.增加反应物的浓度
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
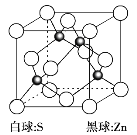
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。