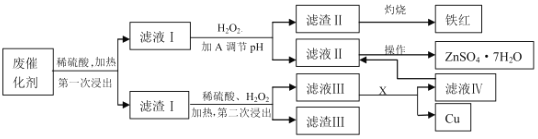
题目内容
【题目】将10 mL pH =1的CH3COOH 溶液加水稀释至100 mL后,溶液的pH为
A. 2 B. 2<pH<7 C. 1<pH<2 D. 无法判断
【答案】C
【解析】
CH3COOH为弱酸,加水稀释促进醋酸的电离,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L×![]() =0.01mol/L,以此解答。
=0.01mol/L,以此解答。
CH3COOH为弱酸,加水稀释促进醋酸的电离,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L×![]() =0.01mol/L,所以稀释后溶液的pH小于2,加水稀释氢离子浓度减小,则pH变大,所以稀释后溶液的pH>1,综上所述,稀释后的醋酸溶液:1<pH<2,答案选C。
=0.01mol/L,所以稀释后溶液的pH小于2,加水稀释氢离子浓度减小,则pH变大,所以稀释后溶液的pH>1,综上所述,稀释后的醋酸溶液:1<pH<2,答案选C。

【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
②既能提高反应速率,又能提高H2转化率的方法是___________(填序号)。
A.加入过量CO2气体 B.升高温度 C.适当压缩容器体积 D. 将CH3OCH3(g) 分离出去
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。