题目内容
【题目】下列说法正确的是

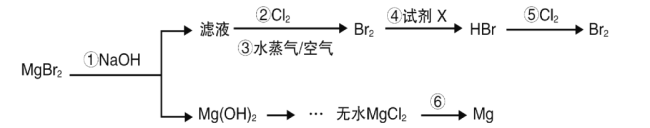
A.图①中△H1=△H2+△H3
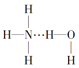
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
【答案】C
【解析】
A项,根据盖斯定律可知△H3=-(△H1+△H2),则△H1=-(△H3+△H2),故A项错误;
B项,因为E1>E2图②在催化剂条件下,反应的活化能等于E1,故B项错误;
C项,NaOH 和氨水混合溶液滴入醋酸,NaOH先与醋酸反应生成醋酸钠,氢氧化钠与醋酸钠均为强电解质且离子带电荷数相同,但加入醋酸溶液体积增大,单位体积内电荷数目减少,故溶液导电能力减弱;当氢氧化钠反应完毕后再滴加醋酸,氨水与醋酸反应生成醋酸铵,醋酸铵为强电解质,一水合氨为弱电解质,故随着醋酸滴入溶液导电能力逐渐增强,当氨水反应完后加入醋酸,溶液体积增大,故溶液导电能力逐渐减小,故C项正确;
D项,图④只表示由CO(g)生成CO2(g)的能量变化,并不能表示具体的反应过程,故D项错误。
本题选C。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目