题目内容
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。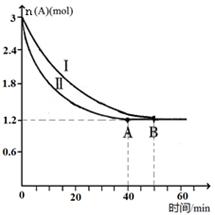
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
(1) (ΔH1-ΔH2) /2 ;(K1/K2)1/2(只要表示方式正确均给分)
(2)①加压,加催化剂(2分,少一种扣1分,错一种倒扣1分);
②9/14(3分,有单位的扣1分);0.012 mol?L-1?min-1(单位错误或不写单位均扣1分。)
(3)3;
(4)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)(;减小(1分),增大(1分)(没有按要求填写的不得分,如“增加”等)。
解析试题分析:(1)第一个反应计量数同除以2,第二个反应的逆反应计量数同除以2,相加可得要求的反应,根据盖斯定律,?H=-1/2?H1—1/2?H2= (ΔH1-ΔH2) /2 ;分步反应加和,平衡常数为相乘,系数变化的倍数为指数,则K=(K1/K2)1/2
(2)①反应II反应速率加快,但平衡时A的物质的量不变,说明平衡不移动,因为该反应气体的系数不变,所以可能改变的条件是:加压,加催化剂
②根据“三段式”进行计算:A(g)+B(g)  C(g)+D(g)
C(g)+D(g)
初始浓度(mol?L?1) 1 2 0 0
初始浓度(mol?L?1) 0.6 0.6 0.6 0.6
初始浓度(mol?L?1) 0.4 1.4 0.6 0.6
平衡常数=0.6mol/L×0.6mol/L÷(0.4mol/L×1.4mol?L?1)= 9/14;
A的反应速率="0.6" mol/L÷40min=0.012 mol?L-1?min-1
(3)HCN的电离方程式为:HCN 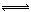 H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol?L?1=10-5mol?L-1,解得c(H+)=10-3mol?L-1,pH=—lgc(H+)=3。
H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol?L?1=10-5mol?L-1,解得c(H+)=10-3mol?L-1,pH=—lgc(H+)=3。
(4)Na2CO3为弱酸强碱盐,CO32?发生水解反应,第一步反应为:CO32?+H2O  HCO3?+OH?,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。
HCO3?+OH?,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。
考点:本题考查焓变、平衡常数、反应速率、pH的计算,离子浓度比较。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。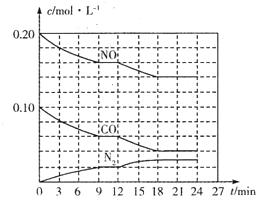
①CO在0-9min内的平均反应速率v(CO)=________mol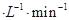 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol
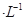 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。 在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是 。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
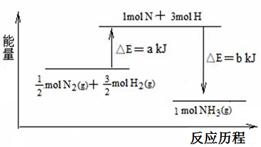
已知:①a=1127;②b=1219
则:1molN2和3molH2参与反应生成2molNH3 (填“吸收”或“放出”)热量 KJ。
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
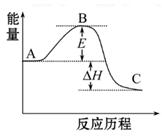
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
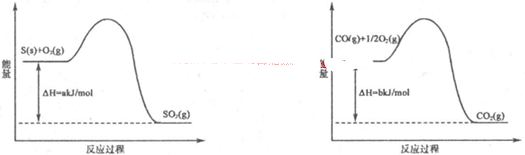
则用SO2除去CO的热化学方程式为 。
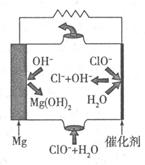
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。
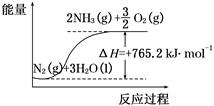
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g)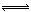 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1