题目内容
【题目】Ⅰ.取1.43g Na2CO3·xH2O 溶于水配成10mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0mL,并收集到112mL CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目__________。
(2)反应产物中,氧化产物与还原产物的物质的量之比为__________。
【答案】 5 mol·L-1 286g·mol-1 10  5:1
5:1
【解析】Ⅰ.n(CO2)=![]() =0.005mol,根据方程式可知
=0.005mol,根据方程式可知
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
1mol 2mol 1mol
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)=![]() =5.0mol/L;(2)n(Na2CO3xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3xH2O)=1.43g÷0.005mol=286g/mol;(3)由摩尔质量可知:106+18x=286,解得x=10;
=5.0mol/L;(2)n(Na2CO3xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3xH2O)=1.43g÷0.005mol=286g/mol;(3)由摩尔质量可知:106+18x=286,解得x=10;
Ⅱ.(1)反应中碘元素化合价从+5价降低到0价,得到5个电子,硫元素化合价从+4价升高到+6价,失去2个电子,根据电子得失守恒可知电子转移的方向和数目可表示为 ;(2)反应中S元素的化合价升高,则S元素失去电子被氧化,生成硫酸钠,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知生成1mol氧化产物转移2mol电子,生成1mol还原产物,转移10mol电子,根据转移电子数守恒知氧化产物与还原产物的物质的量比为5:1。
;(2)反应中S元素的化合价升高,则S元素失去电子被氧化,生成硫酸钠,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知生成1mol氧化产物转移2mol电子,生成1mol还原产物,转移10mol电子,根据转移电子数守恒知氧化产物与还原产物的物质的量比为5:1。

【题目】⑴为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
实验要求 | 化学试剂 |
检验酒精中是否有水 | _____ |
区别CH4和C2H4两种无色气体 | _____ |
验证味精是否有食盐 | _____ |
除去Fe2O3中的Al2O3 | _____ |
供选择的化学试剂:
A.酸性高锰酸钾 B.硝酸银溶液和硝酸 C.氢氧化钠溶液 D.无水硫酸铜粉末
⑵红热木炭与浓H2SO4反应的化学方程式是 C+2H2SO4 ![]() CO2↑+2SO2↑+2H2O ,该反应中浓硫酸的作用是___________________。按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。已知图中4个洗气瓶均装有检测液。现给出4种溶液①品红溶液②酸性高锰酸钾溶液③品红溶液④澄清石灰水。试回答下列问题。
CO2↑+2SO2↑+2H2O ,该反应中浓硫酸的作用是___________________。按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。已知图中4个洗气瓶均装有检测液。现给出4种溶液①品红溶液②酸性高锰酸钾溶液③品红溶液④澄清石灰水。试回答下列问题。
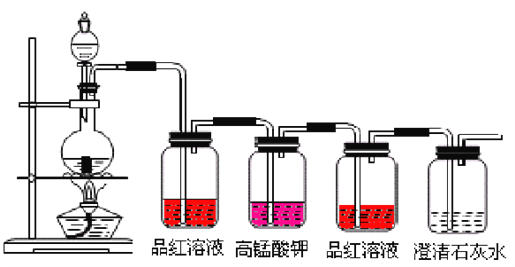
第一个洗气瓶中品红溶液褪色,体现了二氧化硫具有________________性。
第一个洗气瓶的作用是______________________________________________。
第二个洗气瓶中高锰酸钾溶液褪色,体现了二氧化硫具有______________性。