题目内容
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子。它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分别制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为___________________、__________________。制得等量H2所需能量较少的是_________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=___________,反应平衡常数K=__________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__________(填标号)。
A.H2S B.CO2 C.COS D.N2
【答案】 H2O(l)=H2(g)+ ![]() O2(g) ΔH=286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=20 kJ/mol 系统(Ⅱ) 2.5%;2 .8×10-3(或2.85×10-3或1/351) > > B
O2(g) ΔH=286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=20 kJ/mol 系统(Ⅱ) 2.5%;2 .8×10-3(或2.85×10-3或1/351) > > B
【解析】(1)根据盖斯定律,把系统(Ⅰ)的三个热化学方程式相加可得:H2O(l)=H2(g)+ ![]() O2(g) ΔH=286 kJmol-1;把系统(Ⅱ)的三个热化学方程式相加可得:H2S(g)=H2(g)+S(s) ΔH=20 kJmol-1;由上述两个热化学方程式可得,制得1mol H2,系统(Ⅰ)需要吸收286kJ能量,系统(Ⅱ) 需要吸收20kJ能量,所以制得等量H2所需能量较少的是系统(Ⅱ)。
O2(g) ΔH=286 kJmol-1;把系统(Ⅱ)的三个热化学方程式相加可得:H2S(g)=H2(g)+S(s) ΔH=20 kJmol-1;由上述两个热化学方程式可得,制得1mol H2,系统(Ⅰ)需要吸收286kJ能量,系统(Ⅱ) 需要吸收20kJ能量,所以制得等量H2所需能量较少的是系统(Ⅱ)。
(2)设反应的H2S物质的量为x,由题意列三段式得:

因为反应平衡后水的物质的量分数为0.02,所以![]() =0.02,解得x=0.01;①H2S的平衡转化率α1=0.01÷0.40×100%=2.5%;反应平衡常数K=
=0.02,解得x=0.01;①H2S的平衡转化率α1=0.01÷0.40×100%=2.5%;反应平衡常数K=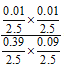 =
=![]() ≈2.849×10-3(或2.8×10-3或2.85×10-3)。
≈2.849×10-3(或2.8×10-3或2.85×10-3)。
②由已知,升温,水的物质的量分数增大,所以升温时平衡正向移动,故α2>α1,ΔH>0。
③A项,再充入H2S,平衡正向移动,使CO2转化率增大,根据化学平衡移动原理,H2S的转化率减小,故A错误;B项,再充入CO2,平衡正向移动,在不改变H2S初始量的前提下,使H2S转化率增大,故B正确;C项,再充入COS,平衡逆向移动,使H2S的转化率减小,故C错误;D项,再充入N2,与该反应无关,平衡不移动,H2S的转化率不变,故D错误。综上选B。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案