题目内容
【题目】碳及其化合物与人类生产、生活密切相关.
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S.
已知:C(s)+ ![]() O2(g)=CO(g)△H1=﹣126.4kJmol﹣1
O2(g)=CO(g)△H1=﹣126.4kJmol﹣1
C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1
S(s)+O2(g)=SO2(g)△H3=﹣296.8kJmol﹣1
则SO2氧化CO的热化学反应方程式为
(2)一种新型CO燃料电池工作原理如图所示.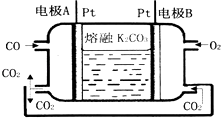
①负极电极反应式:;正极电极反应式: .
②电极A处产生的CO2有部分参与循环利用,其利用率为 .
【答案】
(1)SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJ?mol﹣1
(2)CO+CO32﹣﹣2e﹣=2CO2;O2+4e﹣+2CO2═2CO32﹣;50%
【解析】解:(1)已知:①C(s)+ ![]() O2(g)═CO(g)△H1=﹣126.4kJ/mol②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1③S(s)+O2(g)═SO2(g)△H3=﹣296.8kJmol﹣1依据盖斯定律计算②×2﹣①×2﹣③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;所以答案是:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;
O2(g)═CO(g)△H1=﹣126.4kJ/mol②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1③S(s)+O2(g)═SO2(g)△H3=﹣296.8kJmol﹣1依据盖斯定律计算②×2﹣①×2﹣③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;所以答案是:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;
(2)①负极是一氧化碳发生氧化反应,生成二氧化碳,电极反应式为:CO+CO32﹣﹣2e﹣=2CO2 , 正极电极反应为:O2+4e﹣+2CO2═2CO32﹣ , 所以答案是:CO+CO32﹣﹣2e﹣=2CO2;O2+4e﹣+2CO2═2CO32﹣;
②根据负极2CO+2CO32﹣﹣4e﹣=4CO2 , 而正极反应为O2+4e﹣+2CO2═2CO32﹣ , 所以在转移4mol电子相同的情况下负极产生4mol的二氧化碳,而正极消耗2mol的二氧化碳,所以利用率为50%,所以答案是:50%.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案

