题目内容
【题目】在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A. α1<α3<α2<α4 B. α3<α2<α1<α4 C. α2=α3<α1<α4 D. α2=α3<α4<α1
【答案】D
【解析】在25℃时,纯水中H2O![]() H++OH-,Kw=c(H+)c(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol/L,纯水的电离度为α1;pH=3的醋酸中C(H+)=10-3mol/L,根据Kw=c(H+)c(OH-)=10-14,所以溶液中c(OH-)=
H++OH-,Kw=c(H+)c(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol/L,纯水的电离度为α1;pH=3的醋酸中C(H+)=10-3mol/L,根据Kw=c(H+)c(OH-)=10-14,所以溶液中c(OH-)=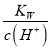 =
=![]() mol/L=10-11mol/L,溶液中c(OH-)来自于水的电离,水电离出的c(H+)=c(OH-)=10-11mol/L,pH=3的醋酸中水的电离度为α2,α2<α1;pH=11的氢氧化钠溶液中c(H+)=10-11mol/L,溶液中c(H+)来自于水的电离,水电离出的c(H+)= c(OH-)=10-11mol/L,pH=11的氢氧化钠溶液中水的电离度为α3,α2=α3<α1;醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠等体积混合,发生反应CH3COOH+NaOH═CH3COONa+H2O,酸碱中和反应放热,由于水的电离是吸热过程,温度升高,促进水的电离,平衡向着正向移动,生成的盐为强碱弱酸盐,水解促进水的电离,但这些影响都是微弱的,影响最大的是醋酸过量,酸抑制水的电离,但酸的量很小,抑制程度比醋酸和氢氧化钠溶液的低,所以反应后所得溶液中水的电离度为α2=α3<α4<α1,答案选D。
mol/L=10-11mol/L,溶液中c(OH-)来自于水的电离,水电离出的c(H+)=c(OH-)=10-11mol/L,pH=3的醋酸中水的电离度为α2,α2<α1;pH=11的氢氧化钠溶液中c(H+)=10-11mol/L,溶液中c(H+)来自于水的电离,水电离出的c(H+)= c(OH-)=10-11mol/L,pH=11的氢氧化钠溶液中水的电离度为α3,α2=α3<α1;醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠等体积混合,发生反应CH3COOH+NaOH═CH3COONa+H2O,酸碱中和反应放热,由于水的电离是吸热过程,温度升高,促进水的电离,平衡向着正向移动,生成的盐为强碱弱酸盐,水解促进水的电离,但这些影响都是微弱的,影响最大的是醋酸过量,酸抑制水的电离,但酸的量很小,抑制程度比醋酸和氢氧化钠溶液的低,所以反应后所得溶液中水的电离度为α2=α3<α4<α1,答案选D。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目