题目内容
6.某有机化合物A的结构简式如图: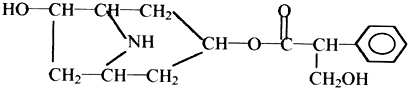
(1)A分子中的含氧官能团的名称是醇羟基、酯基;
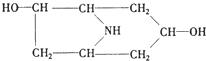
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物.B和C的结构简式分别是
B:
 、C:
、C: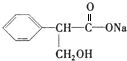 . 该反应属于水解反应;
. 该反应属于水解反应;(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
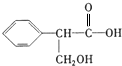 ;
;(4)在下列物质中:
①浓H2SO4和浓HNO3的混合液、CH3CH2OH(酸催化)
③CH3CH2CH2CH3
②Na、CH3COOH(酸催化)
不能与E发生化学反应的是(填写序号)③.
(5)写出E的同时符合下列两项要求的所有同分异构体的结构简式
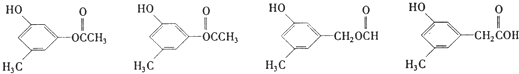 任意两种.
任意两种.②化合物是l,3,5-三取代苯;
③环上的三个取代基分别为甲基、羟基和含有-COO-结构的基团.
分析 (1)根据有机物A的结构确定其官能团;
(2)A中含有酯基,在NaOH水溶液中加热反应得到B和C,C是芳香化合物,则B的结构简式为 ,C的结构简
,C的结构简 ;
;
(3)C用稀盐酸酸化得到E,则C中-COONa转化为-COOH;
(4)B含有醇羟基,能与发生酯化反应、消去反应,能形成醚,能与金属钠反应;
(5)E的同分异构体满足:①化合物是1,3,5-三取代苯,②苯环上的三个取代基分别为甲基、羟基和含有C=O结构的基团,侧链为-OH、-CH3、-OOCCH3,或侧链为-OH、-CH3、-CH2OOCH,或侧链为-OH、-CH3、-COOCH3,或侧链为-OH、-CH3、-CH2COOH.
解答 解:(1)根据有机物A的结构 ,可知其含有醇羟基、酯基,故答案为:醇羟基、酯基;
,可知其含有醇羟基、酯基,故答案为:醇羟基、酯基;
(2)A中含有酯基,在NaOH水溶液中加热发生水解反应得到B和C,C是芳香化合物,则B的结构简式为 ,C的结构简
,C的结构简 ,故答案为:
,故答案为: ;
; ;水解;
;水解;
(3)C用稀盐酸酸化得到E,则C中-COONa转化为-COOH,则E的结构简式为: ,故答案为:
,故答案为: ;
;
(4)B含有醇羟基,能与羧酸、硝酸发生酯化反应,可以发生消去反应,能与乙醇形成醚,能与金属钠反应,不能发生正丁烷反应,故选:③;
(5)E的同分异构体满足:①化合物是1,3,5-三取代苯,②苯环上的三个取代基分别为甲基、羟基和含有C=O结构的基团,侧链为-OH、-CH3、-OOCCH3,或侧链为-OH、-CH3、-CH2OOCH,或侧链为-OH、-CH3、-COOCH3,或侧链为-OH、-CH3、-CH2COOH,符合条件的同分异构体有: ,
,
故答案为: 任意两种.
任意两种.
点评 本题考查有机物结构与性质、官能团性质、有机反应类型、同分异构体书写等,难度中等,注意官能团的性质是关键,同分异构体书写为易错点.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案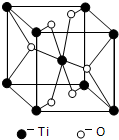 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是A D.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CNO-互为等电子体微粒的化学式为CO2(N2O)、SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
| A. | vA=0.5mol/(L•s) | B. | vB=0.2mol/(L•s) | C. | vC=0.9mol/(L•s) | D. | vD=1.1mol/(L•s) |
| A. |  四种基本反应类型有氧化还原反应的关系 | |
| B. |  AlCl3溶液中滴加NaOH溶液生成沉淀的情况 | |
| C. | 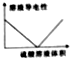 Ba(OH)2溶液中滴加硫酸溶液时的导电性情况 | |
| D. |  等体积、等浓度的稀硫酸分别与足量的铁和镁反应的情况 |
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{V{t}_{1}}$mol/(L-min)
(5)已知:2H2(g)+O2(g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
| A. | 制备Fe(OH)3胶体:Fe3++3OH-=Fe(OH)3↓ | |
| B. | 稀硝酸中加入过量的铁粉:3Fe+2NO${\;}_{3}^{-}$+8H+=3Fe2++2NO↑+4H2O | |
| C. | 向Na2SiO3溶液中加入通入过量的H2S:SiO32-+H2SiO3↓+S2- | |
| D. | 向含amolFel2的水溶液中通入amol的Cl2反应为:2Fe2-+2l-+2Cl2=2Fe2++4Cl-+l2 |
| A. | 在28 g聚乙烯树脂中,含有的碳原子数目为2NA | |
| B. | 在合成28 g聚乙烯树脂的单体中,含有的双键数目为NA | |
| C. | 28 g聚乙烯树脂完全燃烧时,转移的电子数目为3NA | |
| D. | 28 g聚乙烯树脂中,含有的C-H键的数目为4NA |