题目内容
14.有一包白色固体,可能是NaCl、BaCl2、K2CO3、K2SO4、CuSO4和中的一种或几种.将此白色固体溶解于水时,有生成,过滤后,滤液为无色.①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成.
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解.
通过上述实验现象分析:该白色固体中一定含有的物质为K2CO3、BaCl2,不可能含有的物质为K2SO4、CuSO4,不能确定的物质是NaCl,为了确定该物质是否存在,可以通过焰色反应实验确定.
分析 白色固体溶解于水时,有生成,过滤后,滤液为无色,则一定不含CuSO4;
由①可知沉淀为碳酸钡,则一定含BaCl2、K2CO3,一定不含K2SO4;
由②可知白色沉淀为AgCl,以此来解答.
解答 解:白色固体溶解于水时,有生成,过滤后,滤液为无色,则一定不含CuSO4;
由①可知沉淀为碳酸钡,则一定含BaCl2、K2CO3,一定不含K2SO4;
由②可知白色沉淀为AgCl,一定含氯离子,因一定含BaCl2,不能确定是否含NaCl,
综上所述,该白色固体中一定含有的物质为K2CO3、BaCl2,不可能含有的物质为K2SO4、CuSO4,不能确定的物质是NaCl,为了确定该物质是否存在,可以通过焰色反应检验,
故答案为:K2CO3、BaCl2; K2SO4、CuSO4;NaCl;焰色反应.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质的性质、离子的颜色、实验中的白色沉淀为解答的关键,侧重分析与应用、推断能力的综合考查,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
4.固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染.下列物质中可用做固硫剂的有( )
| A. | CaO | B. | P2O5 | C. | NH4NO3 | D. | Na2CO3 |
2.对下列物质的用途解释不正确的是( )
| 用途 | 解释 | |
| A | 氨常用作制冷剂 | 液氨汽化时要吸收大量的热,使周围温度降低 |
| B | SO2 可用于漂白纸浆 | SO2 具有氧化性 |
| C | 明矾可用于净水 | 明矾在水中生成的氢氧化铝胶状物质,有吸附性 |
| D | 常温下,可用铁、铝制容器盛装浓硝酸 | 铁、铝表面被氧化成的致密氧化物薄膜,阻止了酸与内层金属的进一步反应 |
| A. | A | B. | B | C. | C | D. | D |
9. 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
3.如果ag某气体中含有分子数为b,则cg该气体在标准状况下的体积是( )
| A. | $\frac{22.4b}{ac{N}_{A}}$L | B. | $\frac{22.4ab}{c{N}_{A}}$L | C. | $\frac{22.4ac}{b{N}_{A}}$L | D. | $\frac{22.4bc}{a{N}_{A}}$L |
1.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
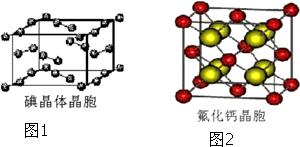
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.


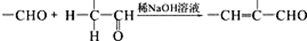 ;
; 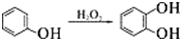
 .
.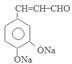 +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$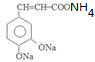 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. (任三种).
(任三种).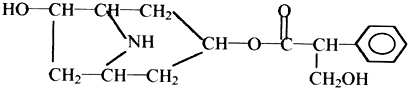
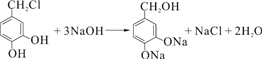
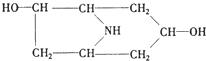 、C:
、C: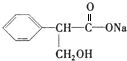 . 该反应属于水解反应;
. 该反应属于水解反应;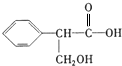 ;
;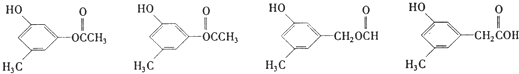 任意两种.
任意两种.