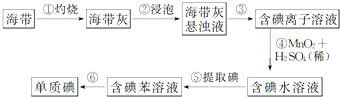
题目内容
【题目】天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
(1)硫元素的原子结构示意图为;羰基硫分子的电子式为 .
(2)下列说法正确的是 . a.乙硫醇的相对分子质量大于乙醇,故其沸点更高
b.同温度同浓度下Na2CO3溶液的pH大于Na2SO4溶液,说明硫元素非金属性强于碳元素
c.H2S分子和CO2都是极性分子,因为它们都是直线形分子
d.由于乙基的影响,乙硫醇的酸性弱于H2S
(3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去): COS ![]() Na2S溶液
Na2S溶液 ![]() X溶液+H2
X溶液+H2
①反应I除生成两种正盐外,还有水生成,其化学方程式为 .
②已知X溶液中硫元素的主要存在形式为S2O32﹣ , 则Ⅱ中主要反应的离子方程式为 .
③如图是反应Ⅱ中,在不同反应温度下,反应时间与H2产量的关系图(Na2S初始含量为3mmo1).
a.判断T1、T2、T3的大小:;
b.在T1温度下,充分反应后,若X溶液中除S2O32﹣外,还有因发生副反应而同时产生的SO42﹣ , 则溶液中c(S2O32﹣):c(SO42﹣)= . 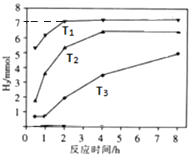
【答案】
(1)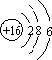 ;
;![]()
(2)bd
(3)COS+4NaOH=Na2S+Na2CO3+2H2O;2S2﹣+5H2O=S2O32﹣+4H2↑+2OH﹣;T1>T2>T3;5:2
【解析】解:(1)S的质子数为16,原子核外有3个电子层,最外层电子为6,则原子结构示意图为 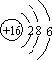 ;羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为
;羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为 ![]() , 所以答案是:
, 所以答案是: 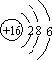 ;
; ![]() ;(2)a.乙醇中含氢键,则乙醇沸点高于乙硫醇,故a错误;
;(2)a.乙醇中含氢键,则乙醇沸点高于乙硫醇,故a错误;
b.同温度同浓度下Na2CO3溶液的pH大于Na2SO4溶液,可知对应最高价含氧酸的酸性为硫酸>碳酸,则硫元素非金属性强于碳元素,故b正确;
c.CO2结构对称,正负电荷中心重合,则为非极性分子,为直线结构,而H2S分子V型极性分子,故c错误;
d.由于乙基的影响,乙硫醇难电离出氢离子,乙硫醇的酸性弱于H2S,故d正确;
所以答案是:bd;(3)①反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3 , 反应为COS+4NaOH=Na2S+Na2CO3+2H2O,
所以答案是:COS+4NaOH=Na2S+Na2CO3+2H2O;
②硫化钠与水反应生成S2O32﹣、氢气和氢氧化钠,其反应的离子方程式为:2S2﹣+5H2O=S2O32﹣+4H2↑+2OH﹣ , 所以答案是:2S2﹣+5H2O=S2O32﹣+4H2↑+2OH﹣;
③a.由图可知,温度高的反应速率大,则反应的时间短,则T1>T2>T3 , 所以答案是:T1>T2>T3;
b.3molNa2S若只生成S2O32﹣转移12mol电子,T1温度下,生成的氢气为7mol,转移电子为14mol,设产生的SO42﹣为x,由电子守恒可知x×8+(3﹣x)×4=14,解得x=0.5mol,则n(S2O32﹣)= ![]() =1.25mol,溶液中c(S2O32﹣):c(SO42﹣)=1.25:0.5=5:2,
=1.25mol,溶液中c(S2O32﹣):c(SO42﹣)=1.25:0.5=5:2,
所以答案是:5:2.