题目内容
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
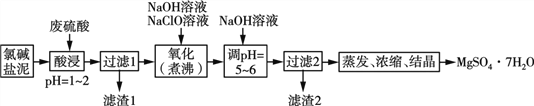
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
【答案】 FeCO3+2H+![]() Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-
Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-![]() MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-
MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-![]() MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶CC∶]2- 4MgCO3·Mg(OH)2·5H2O
MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶CC∶]2- 4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O
5MgO+4CO2↑+6H2O
【解析】(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为FeCO3+2H+=Fe 2++CO2↑+H2O;盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]中只有二氧化硅不溶于硫酸,同时碳酸钙与硫酸反应会生成硫酸钙沉淀,因此滤渣1的主要成分为CaSO4和SiO2; a. 多次用废硫酸浸取,可以使盐泥中的物质充分溶解;b. 减小盐泥粒度并充分搅拌,c. 延长浸取时间,d.适当的提高酸浸的温度,都可以提高浸取率,故选abcd,故答案为:FeCO3+2H+=Fe 2++CO2↑+H2O;SiO2;abcd;
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为Mn2++2OH-+ClO- =MnO2↓+Cl-+H2O,调节pH=5~6,可以沉淀铁离子、铝离子,形成氢氧化铁和氢氧化铝沉淀,故滤渣2为MnO2和Fe(OH)3、Al(OH)3,故答案为:Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O;Fe(OH)3、Al(OH)3;
(3) MgC2发生水解反应生成乙炔,则MgC2与碳化钙的结构相似,电子式为Mg2+![]() ,故答案为:Mg2+
,故答案为:Mg2+![]() ;
;
(4)碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]受热分解生成氧化镁和二氧化碳,以及水,氧化镁熔点较高,可以覆盖在可燃物表面,起到隔绝氧气的作用,同时二氧化碳和水也可以帮助灭火,反应的方程式为4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O,故答案为:4MgCO3·Mg(OH)2·5H2O
5MgO+4CO2↑+6H2O,故答案为:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O。
5MgO+4CO2↑+6H2O。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案