题目内容
(1)NO是污染大气的有毒气体.为了消除NO的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是______.
(2)汽车尾气产生的NO2可以在一定条件下和CO反应生成无毒物质,其反应方程式可表示为:2NO2+4CO═N2+4CO2,该反应的氧化剂是______,每生成1mol N2,反应中转移电子为______mol.
解:(1)NO与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,结合氮元素守恒可知,该物质为氮气,反应方程式为:6NO+4NH3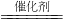 5N2+6H2O,
5N2+6H2O,
故答案为:6NO+4NH3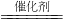 5N2+6H2O;
5N2+6H2O;
(2)反应2NO2+4CO═N2+4CO2中,NO2中N元素化合价由+4价降低为N2中的0价,NO2是氧化剂;
反应中氮气为还原产物,氮元素化合价由+4价降低为0价,故每生成1mol N2,转移电子的物质的量=1mol×2×(4-0)=8mol,
故答案为:NO2;8.
分析:(1)NO与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,结合氮元素守恒可知,该物质为氮气,据此书写;
(2)所含元素化合价降低的反应物是氧化剂;
反应中氮气为还原产物,氮元素化合价由+4价降低为0价,据此计算.
点评:本题考查氮的化合物性质、氧化还原反应等,比较基础,注意基础知识的理解掌握.
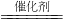 5N2+6H2O,
5N2+6H2O,故答案为:6NO+4NH3
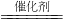 5N2+6H2O;
5N2+6H2O;(2)反应2NO2+4CO═N2+4CO2中,NO2中N元素化合价由+4价降低为N2中的0价,NO2是氧化剂;
反应中氮气为还原产物,氮元素化合价由+4价降低为0价,故每生成1mol N2,转移电子的物质的量=1mol×2×(4-0)=8mol,
故答案为:NO2;8.
分析:(1)NO与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,结合氮元素守恒可知,该物质为氮气,据此书写;
(2)所含元素化合价降低的反应物是氧化剂;
反应中氮气为还原产物,氮元素化合价由+4价降低为0价,据此计算.
点评:本题考查氮的化合物性质、氧化还原反应等,比较基础,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目