题目内容
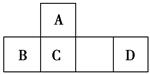
根据不同的研究目的,可以编制成不同的元素周期表。将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”元素周期表,图中每个“.”代表一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是
| A.Y点元素对应的氢化物比z点元素对应的氢化物更稳定 |
| B.虚线相连的两个点元索处于同一族 |
| C.比Y点原子序数小8的元素,它的最高氧化物对应的水化物是一种弱酸 |
D.K、L、X三种元素的离子半径大小顺序是X3+> >K2- >K2- |
B
解析试题分析:根据如图所示的“蜗牛”元素周期表可以确定:P点是H元素;K点为O元素;L点为Na元素;M点为Mg元素;X点为Al元素;Y点为P元素;Z点为Cl元素。A. Y点为P元素, Z点为Cl元素,P、Cl为同周期的元素,非金属性Cl>P。元素的非金属性越强,其对应的氢化物的稳定性就越强。所以稳定性:HCl>PH3。错误。B. K点为O元素;Z点为Cl元素,与Cl相连的点为F元素。F、Cl为第VIIA的元素。正确。C. Y点为15号元素P,比它小8号的元素为7号元素N,它的最高氧化物对应的水化物是HNO3是一种强酸 。错误。D.K、L、X三点对应的元素分别是O、Na、Al。这三种元素对应的离子电子层结构相同都是2、8的电子层结构。对于电子层结构相同的元素来说,核电荷数越大,离子半径就越小。所以它们相应的的离子半径大小顺序是O2->Na+>Al3+.错误。
考点:考查元素周期表、元素周期律、离子半径的大小比较的知识。

下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
下列说法正确的是
| A.N和As属于第VA族元素,N原子得电子能力比As原子强 |
| B.族序数等于其周期序数的元素一定是金属元素 |
| C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素 |
| D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强 |
下列关于科学家及其提出学说、贡献的叙述错误的是
| A.道尔顿提出原子学说 |
| B.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
| C.汤姆生发现电子,并提出原子结构轨道模型 |
| D.舍勒发现了氯气 |
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图:地壳中含量最大的三种元素已包含其中。关于这些元素的叙述不合理的是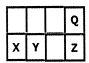
| A.最高价氧化物对应水化物的酸性Z>Y |
| B.原子半径X>Y |
| C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液 |
| D.元素Y的氧化物是形成酸雨的罪魁祸首 |
下列说法不正确的是( )
| A.多孔碳可用作氢氧燃料电池的电极材料 |
| B.pH计不能用于酸碱中和滴定终点的判断 |
| C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 |
D.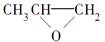 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 |
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法中正确的是 ( )。
| | X | | Y | |
| | | | W | |
A.X、Z、W、Q四种元素的最高价氧化物所对应的水化物均不可能呈现出酸性
B.Y的简单阴离子比W的简单阴离子的还原性弱
C.X、W、Q的氢化物均可在Y的单质中燃烧
D.Q的非金属性弱于W的非金属性